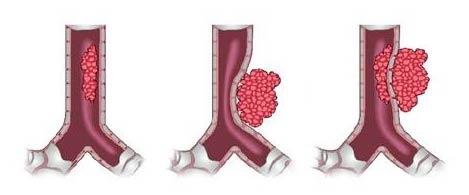
Инвазия всей толщины мышечной оболочки кишечника представляет собой серьезное патологическое состояние, которое может быть вызвано различными инфекционными агентами, такими как паразиты или бактерии. Это состояние может привести к выраженному воспалению, нарушению перистальтики и даже к развитию кишечной непроходимости.
Симптомы могут варьироваться от боли в животе и нарушений стула до более серьезных проявлений, таких как перфорация кишечника. Лечение обычно предполагает применение антибактериальной или противопаразитарной терапии, в некоторых случаях может потребоваться хирургическое вмешательство для восстановления целостности кишечника.
- Инвазия всей толщины мышечной оболочки кишечника представляет собой серьезное патологическое состояние.
- Часто связана с злокачественными новообразованиями, такими как рак кишечника.
- Может вызвать симптомы, включая боль в животе, нарушения пищеварения и неотложные состояния.
- Диагностика включает эндоскопию, УЗИ и компьютерную томографию.
- Лечение требует комплексного подхода: хирургическое вмешательство, химиотерапия и радиотерапия.
- Ранняя диагностика и адекватное лечение существенно улучшают прогноз для пациента.
Доброкачественные образования ободочной кишки
Пока не установлены окончательные причины, способствующие формированию доброкачественных опухолей в толстом кишечнике. Один из самых важных факторов, оказывающих влияние на возникновение этих новообразований, — это наследственность. Если у близких родственников имеются полипы в кишечнике, вероятность появления доброкачественных опухолей у вас существенно возрастает.
- Эпителиальные (аденоматозные полипы, тубуло-ворсинчатые аденомы, диффузный полипоз).Все перечисленные опухоли относятся к облигатным предракам.
- Аденоматозные полипы – это округлые опухолевые структуры, которые могут находиться на узкой стебельке или у основания. Чаще всего они обнаруживаются случайно во время профилактического эндоскопического исследования.
- Ворсинчатые опухоли составляют от 2 до 15% всех опухолей толстой кишки. У них экзофитный тип роста с наличием ножки или широкого основания. Они имеют высокую вероятность малигнизации.
- Диффузный полипоз – это серьезное заболевание, которое в почти всех случаях приводит к рак. Резекция пораженного участка кишки является единственным эффективным методом радикального лечения.
- Неэпителиальные опухоли (липомы, лейомиомы, ангиомы).Эти опухоли встречаются реже.
- Липома – это наиболее распространенная доброкачественная опухоль неэпителиального характера, по частоте она немного уступает полипам и характеризуется мягкой консистенцией.
- Лейомиома развивается из гладкомышечных волокон и является редким видом новообразования.
- Гемангиома зарождается из сосудистых тканей толстого кишечника и чаще всего располагается вблизи анального канала. Эта форма доброкачественной опухоли часто приводит к кишечным кровотечениям.
Клиническая симптоматика доброкачественных опухолей толстого кишечника зависит от их размеров. Небольшие по размеру новообразования могут никак не проявляться и часто обнаруживаются только во время эндоскопии. Поэтому в большинстве случаев такие доброкачественные опухоли толстого кишечника протекают практически бессимптомно. При размерах новообразования более 2 см оно проявляется кровянистыми выделениями при акте дефекации и другим симптомами, которые зависят от структуры и локализации процесса.

В лечении данных заболеваний применяется хирургический подход, подразумевающий удаление опухолей. Фармакотерапия в этой области оказывается неэффективной. Полипоз в любом варианте считается предраковой патологией, что делает его оперативное устранение рекомендуемым. Одиночные полипы удаляются с помощью эндоскопической электрокоагуляции или резекции ободочной кишки.
При выраженном множественном полипозе с высоким риском развития рака может быть рекомендовано радикальное удаление ободочной кишки — колэктомия. После подобных оперативных вмешательств проводятся реконструктивные операции на ободочной кишке, которые позволяют восстановить нормальную работу кишечника.
Метод лечения для других типов доброкачественных опухолей в толстом кишечнике основывается на характеристиках новообразования, его размере и наличии или отсутствии осложнений. Для удаления одиночных доброкачественных опухолей все чаще применяется колоноскопия с эндоскопическим удалением. Этот метод подходит при наличии солитарной опухоли с выраженным стеблем. Эндоскопическое удаление хорошо переносится пациентами, позволяя им восстанавливать обычный образ жизни уже на следующий день.
Удаленные опухоли обязательно направляются на гистологическое исследование для уточнения морфологии и исключения наличия злокачественных клеток. В некоторых случаях требуется хирургическое вмешательство путем выполнения органосохраняющих или радикальных операций. Если возникает ангиома в толстой кишке, что также считается доброкачественным заболеванием, может быть рекомендовано наложение лигатур или криодеструкция.
Спустя год после удаления крупных доброкачественных опухолей целесообразно провести контрольную эндоскопию, чтобы убедиться в отсутствии новых полипов. Если возникают новые новообразования на месте удаленного, их следует снова удалить. При отсутствии новых полипов следующая эндоскопия назначается через три года.
Доброкачественнные новообразования поджелудочной железы
Доброкачественные опухоли поджелудочной железы можно разделить на две основные группы: гормонально активные и гормонально неактивные. Поджелудочная железа состоит из различных клеток, которые отвечают за различные функции. Экзокринные клетки производят ферменты, нужные для пищеварительного процесса, в то время как эндокринные клетки участвуют в регуляции уровня глюкозы.
Доброкачественные опухоли поджелудочной железы встречаются достаточно редко. В целом в общей статистике всех видов новообразований поджелудочной железы доброкачественные опухоли составляют примерно от 0,01 до 0,1%. Мужчины и женщины болеют данным заболеванием с одинаковой частотой.
Гормонально активные опухоли проявляют себя быстро и агрессивно. К ним относится ряд новообразований, среди которых наиболее распространены инсулиномы (таламы) – островковые опухоли, которые даже при размере менее 1 см способны вызвать гипогликемический или гипергликемический криз.
В некоторые моменты они могут выделять значительное количество инсулина, что приводит к серьезным последствиям, включая гипогликемическую кому. В других случаях они, наоборот, мешают нормальному производству инсулина через свои белки и побочные продукты. Наиболее частыми симптомами являются вялость, мышечная слабость, озноб, потливость, раздражительность и психологическая подавленность. Возможен дискомфорт в области поясницы.
Часто возникает состояние, связанное с голодной бурей: некоторые пациенты испытывают болевые ощущения без приема пищи. Кроме того, постоянно возникает обостренное чувство голода.
Гормонально неактивные опухоли делятся на кистозные и некистозные. Кистозные опухоли (цистаденомы) могут быть однокамерными или многокамерными, часто содержат множество мелких (до 1 мм) полостей с жидким содержимым. При увеличении до 10 см они могут начинать оказывать давление на окружающие органы и ткани, что приводит ко вторичному отеку или воспалению, проявляющимся болевыми ощущениями.
В отличие от первой группы, этот тип опухолей дает более сглаженную симптоматику: слабость, тяжесть, тянущие боли. Поэтому их выявление нередко становится диагностической находкой. Сюда же относятся редко встречающиеся псевдопапиллярные опухоли, которые, несмотря на доброкачественную природу, имеют наибольшие показания для удаления с соблюдением онкологических принципов. К некистозным опухолям относятся различные виды аденом, гемангиомы, липомы, крайне редко – фибромы или фибролипомы. Аденомы медленно растут, не имеют симптоматики, могут вырастать до 5 и более сантиметров и также являться неожиданной диагностической находкой.
Диагностика
Методы визуализации, такие как УЗИ, МРТ и ПЭТ-КТ, используются для определения размера опухолевого образования и его местоположения.
- Чрескожная биопсия опухоли поджелудочной железы под контролем УЗИ является важным методом для установления характера опухолевого процесса. С помощью тонкой иглы забирается фрагмент ткани, который затем направляется на гистологическое исследование для выявления раковых клеток и определения типа новообразования.
- Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) — это диагностический метод, который позволяет оценить состояние слизистых желудка, двенадцатиперстной кишки и поджелудочной железы, вводя тонкий эндоскоп с ультразвуковым датчиком в пищевод. Этот метод позволяет также оценить состояние желчных протоков, используя рентгеноконтрастное вещество для определения их проходимости и наличия опухолевых разрастаний.
- Диагностическая лапароскопия используется для введения эндоскопа с оптическим прибором в брюшную полость. Этот метод позволяет визуализировать опухоли в органах живота, определить их размеры, расположение, степень распространенности и провести биопсию.
Симптомы и признаки
Доброкачественные опухоли поджелудочной железы не проявляют клинические признаки до тех пор, пока не достигнут значительных размеров. Часто диагноз устанавливается случайно во время планового УЗИ брюшной полости.
Исключением является инсулома: даже при небольших ее размерах она вызывает нарушения в секреции инсулина, и у больных значительно снижается уровень сахара в крови, что сопровождается:
- Увеличенный аппетит и быстрый набор веса;
- Слабость;
- Беспричинные чувства тревоги;
- Частое потоотделение;
- Учащенное сердцебиение;
- Эпизоды головокружения и двоения в глазах, иногда — потеря сознания.
В процессе роста опухоли и ее воздействия на соседние структуры могут появляться следующие симптомы:
- Боли, возникающие в правом или левом подреберье, в эпигастрии (область под грудиной) или около пупка. Часто имеют опоясывающий характер и могут отдавать в спину. Боли могут возникать независимо от приема пищи.
- Желтуха. Опухоль может нарушать проходимость желчных путей, что приводит к затруднению оттока желчи и желтушности кожи и склер, зуду кожи, обесцвечиванию кала, а моча может приобретать цвет «крепкого чая».
- Кишечная непроходимость. Опухоль может вызывать непроходимость двенадцатиперстной кишки. Это состояние может сопровождаться тошнотой, рвотой и чувством тяжести после еды.
Практически все доброкачественные опухоли поджелудочной железы удаляются лапароскопическим способом. Это низкотравматично, несет минимум послеоперационных осложнений и в 2 раза сокращает реабилитационный период. Открытое вмешательство выполняется крайне редко – при трудностях доступа или если, например, крупная кистозная опухоль содержит жизненно важные сосуды. Многие из перечисленных опухолей удаляются по типу энуклеации – вылущивания опухоли без удаления здоровых тканей железы.
Инвазия всей толщины мышечной оболочки кишечника представляет собой серьезное патологическое состояние, которое требует внимательного изучения. В процессе диагностики важно учитывать как клинические проявления, так и инструментальные методы, такие как ультразвуковое исследование и компьютерная томография. Эти методы позволяют более точно визуализировать пораженные участки, а также определить степень инвазии и сопутствующие изменения со стороны окружающих тканей.
С точки зрения патогенеза, инвазия может быть обусловлена различными факторами, включая инфекционные агенты, опухоли или воспалительные процессы. Важно отметить, что мышечная оболочка кишечника выполняет ключевую роль в обеспечении нормальной моторики и перистальтики. Поэтому при наличии инвазии может возникнуть нарушение этих функций, что приводит к различным клиническим симптомам, таким как боль, диспепсия, кишечная непроходимость и другие проявления. Механизм инвазии может включать как прямое прорастание патологических клеток, так и вторичное воздействие на соседние структуры.
Лечение инвазии всей толщины мышечной оболочки кишечника необходимо проводить комплексно, учитывая причину патологии. В большинстве случаев требуется хирургическое вмешательство для удаления пораженных участков, за которым может следовать дальнейшая врача-контроль и реабилитация. Также следует обратить внимание на методику профилактики, которая включает в себя раннюю диагностику и современное лечение заболеваний, способствующих инвазии, например, хронических воспалительных процессов или опухолей, чтобы снизить риск развития подобных состояний в будущем.
Почему возникает рак сигмовидной кишки
Для сигмовидной кишки выявлено несколько факторов риска, существенно увеличивающих вероятность возникновения опухоли.
Особенности питания
- Чрезмерное употребление красного мяса (свинины, говядины) и животных жиров.
- Недостаток растительных волокон в рационе.
- Употребление алкоголя.
- Переедание и избыточный вес.
Интересно, что у вегетарианцев риск развития колоректального рака значительно ниже в сравнении с обычным рационом. Ранее считалось, что мясо является основным канцерогеном для кишечника, однако исследование показало, что именно пищевые волокна, содержащиеся в рационе вегетарианцев, способствуют очищению кишечника и предотвращают злокачественные изменения.
Наличие полипов
В большинстве случаев рак кишечника развивается из аденоматозных полипов. Чем больше размер и длительность их существования, тем выше вероятность злокачественного превращения.
Наследственность
Наследственная предрасположенность подтверждена для таких состояний, как семейный аденоматозный полипоз и синдром Линча, которые составляют 5–7% всех вмешательств по поводу рака кишечника.
Другие факторы риска
- Воспалительные заболевания толстого кишечника, такие как язвенный колит и болезнь Крона.
- Наличие рака груди и яичников в анамнезе у женщин.
- Состояния иммунодефицита.
Симптомы
Рак сигмовидной кишки на начальной стадии протекает бессимптомно и обнаруживается только при проведении специального обследования. Первые признаки появляются, когда процесс заходит достаточно далеко, опухоль уже приобретает большие размеры и выходит за пределы кишки. Все симптомы рака сигмовидной кишки можно разделить на две большие группы — общие и локальные. К общим симптомам относят:
- Потеря веса без связи с диетами или физическими нагрузками — снижение массы тела более чем на 10% за полгода.
- Анемия — проявляется бледностью кожи и слизистых, отеками тканей, ухудшением состояния волос и ногтей.
- Быстрая утомляемость, снижение общей работоспособности и т.д.

К локальным симптомам относятся:
- Боль в животе. Этот симптом может возникать по разным причинам, начиная от кишечной непроходимости и заканчивая прорастанием опухоли в соседние органы, что также затрагивает нервные окончания.
- Изменения стула. Запор, который иногда сменяется зловонной диареей, является типичным признаком колоректального рака. Это происходит из-за неполной кишечной непроходимости, в результате которой каловые массы накапливаются в проксимальном отделе кишечника. Постепенно там происходят различные микробиологические процессы, такие как гниение и брожение, что приводит к разжижению стула и к опорожнению кишечника.
- Появление патологических выделений из кала. Это могут быть как примеси крови, так и выделения слизи и прочие аномальные элементы.
- Острая кишечная непроходимость — это угрожающее жизни состояние, характеризующееся резкими, спазматическими болями, которые сначала проявляются периодически, а затем становятся постоянными. Это также сопровождется увеличением объема живота, серьезной интоксикацией и может вызывать рвоту, что требует срочной госпитализации и начала лечения.
- К менее явным признакам рака сигмовидной кишки можно отнести вздутие живота, метеоризм и повышенное газообразование.
Особенности внутрикишечной опухолевой инвазии в проксимальном направлении при раке прямой кишки
Аннотация. В работе представлены данные гистологических исследований распространения «ракового поля» в проксимальном направлении при колоректальном раке. Причина необходимости данных исследований заключается в том, что сохранение дистальных участков сигмовидной кишки при передней резекции прямой кишки крайне важно для улучшения функциональности резервуара и эвакуации. Установлено минимальное расстояние, которое следует соблюдать, отступая от верхнего края опухоли при выполнении резекции кишечника, чтобы не нарушить онкологические принципы операций.
Клинические наблюдения о несомненной важности бережного отношения к дистальной части сигмовидной кишки при передних резекциях прямой кишки (ПК), побудили нас изучить распространенность ракового поля в проксимальном направлении от верхнего края раковой опухоли. Знания эти должны лечь в основу рекомендаций, насколько минимально допустимо отступать от верхнего края опухоли при резекции сигмовидной кишки, не нарушая онкологических принципов оперирования. Такая озабоченность связана с тем, что у больных, у которых при резекции ПК для анастомоза использовалась самая дистальная часть низводимой сигмовидной кишки, резервуарно-накопительная и эвакуаторная функции оказывались заметно лучше. Вместе с тем, заботясь об улучшении функциональных результатов операций, мы постоянно имели в виду важность соблюдения онкологических принципов оперирования, поскольку главным при лечении онкологических больных является, конечно, улучшение пятилетней выживаемости.
Распространение ракового процесса внутри стенки от края видимой опухоли в дистальном направлении было предметом изучения для ряда авторов. Эти исследования крайне актуальны при оперативном лечении пациентов с низко расположенной раковой опухолью. При такой локализации злокачественного образования каждый сантиметр сохраненной дистальной части кишки важен с точки зрения функциональных результатов. Применение сшивающих аппаратов при резекции позволяет проводить техничные и максимально низкие резекции кишечника.
Распространенность инвазии в дистальном направлении при раке прямой кишки.
Распространенность раковой инвазии в дистальном направлении изучалась при помощи тщательных морфологических исследований. R.Willis предложил концепцию «опухолевого поля», согласно которой новообразование развивается мультицентрически, с образованием единого опухолевого узла позже.
В.Ю. Клур и коллеги провели серийные гистологические срезы не только в дистальном направлении, но и радиарно. Они отметили, что границы «опухолевого поля» экстентрисентрическое, с внутристеночной инвазией, которая в дистальном направлении достигает не менее 3,5-4,0 см при экзофитных опухолях, в то время как при эндофитном росте увеличивается еще на 1,0-1,5 см.
Г. И. Воробьев с соавт. исследовал 71 препарат прямой кишки, удаленный при брюшно-промежностной экстирпации. Они установили, что глубина опухолевой инвазии прогрессивно уменьшается в направлении от центра к периферии опухоли. Дистальный внутристеночный рост по подслизистому слою был зарегистрирован лишь в 2,2 % случаев и не превышал 15 мм.
Глубина инвазии при колоректальном раке также исследовалась посредством компьютерной томографии и эндоректального ультразвука. Были получены данные о небольшой по extensión инвазии внутри кишечного просвета в дистальном направлении. Это привело к замене «правила 5 см» на «правило 2 см», что подразумевает необходимость отступления 2 см от нижнего края опухоли, чтобы не нарушить основные онкологические принципы операции.
Распространенность опухолевой инвазии в проксимальном направлении в меньшей мере привлекала внимание специалистов. При пересечении кишки выше опухоли не возникает необходимости в строгой экономичности сохранения кишки, примыкающей к опухоли, так как всегда имеется достаточная часть остающегося участка левого фланга ободочной кишки.
Тем не менее, наши результаты, основанные на анализе длины сигмовидной кишки по дооперационным ирригограммам и размерам резецированной части после передней резекции ПК, подчеркивают значимость максимального сохранения дистальной части сигмовидной кишки для формирования анастомоза. Эти выводы были сделаны на основании изучения функциональных результатов сфинктеросохраняющих резекций ПК. Все эти аспекты мотивировали провести специальное исследование распространенности ракового поля в проксимальном направлении от верхнего края видимой опухоли. Полученные результаты понадобились для определения минимального расстояния, необходимого для соблюдения онкологических принципов при пересечении кишки.
Методы исследования. Были изучены 17 макропрепаратов ПК, удаленных в ходе операций по поводу ракового заболевания. Макропрепараты фиксировались в 10%-ном растворе формалина, после чего через 24 часа проводилось морфологическое исследование. Окраска проводилась с помощью гематоксилин-эозина при увеличении 10 х 20.
В 15 случаях раковая опухоль располагалась в нижнеампулярном отделе ПК, в одном — в среднеампулярном и еще в одном — в верхнеампулярном отделе ПК. Раковые опухоли по наибольшему диаметру были различны: от 3 см в диаметре (3) до 5−6 см (7) и даже до 10 см (1). Резецированные участки кишки вместе с опухолью были различной длины: 20−30 см — 4, 30−40 см — 5, 40−50 см — 5, 50−60 см — 3.
В ходе гистологического обследования в 12 случаях была обнаружена аденокарцинома различного уровня дифференцировки, в двух — слизеобразующая аденокарцинома, а в трех случаях — плоскоклеточный рак. В 15 из 17 examined samples наблюдалось прорастание всех слоев стенки ПК. В шести случаях были зарегистрированы метастазы опухоли в регионарные лимфатические узлы. Исследования проводились в Петроградском централизованном патологоанатомическом отделении городского патологоанатомического бюро под руководством Г. И. Суханкиной.

После фиксации препарата в проксимальном направлении от видимого верхнего края опухоли последовательно проводились пересечения кишечной стенки с интервалом 5мм (рис. 1).
При первом образце обязательно учитывалась видимая часть опухоли. В последующих образцах производились три ступенчатых среза на разных уровнях поперечного пересечения стенки кишечника (а, б, в), далее срезы проводились в зависимости от морфологических изменений слизистой оболочки и подлежащих слоев кишечника.
Если в двух последовательных срезах не обнаруживалось никаких морфологических изменений в слоях, то дальнейшее гистологическое исследование прекращалось. В общей сложности было приготовлено и изучено 180 микропрепаратов с помощью светового микроскопа. В большинстве случаев (13 из 17) внутристеночное распространение злокачественной инфильтрации в проксимальном направлении от видимого края опухоли не фиксировалось или ограничивалось несколькими миллиметрами. Данное наблюдение оказалось правдивым как для крупных, так и для меньших по размеру опухолей; как в случаях с метастазами в регионарные лимфоузлы, так и без таковых; при прорастании опухоли в примыкающую жировую ткань и в отсутствие этого; а также не зависело от степени прорастания всей толщины стенки кишечника. Вот несколько иллюстраций данного вывода.
Результаты исследования. Представляем наблюдение, характеризующее отсутствие опухолевой инвазии по кишечной стенке.
Мужчина 54 лет с раком анального канала и ПК перенес брюшнопромежностную экстирпацию ПК. Гистологическое исследование образцов 31261-31272.
Макропрепарат: блюдцеобразно возвышающееся над поверхностью кишки новообразование диаметром 6 см, прорастает все стенки кишки. От края опухоли в проксимальном направлении макроскопически определяется инфильтрация стенки на протяжении 3,5 см.
Микроскопическое исследование показало высокодифференцированную слизеобразующую аденокарциному ПК, прорастание всей толщины стенки кишечника, прорастание опухоли в жировую ткань. В очагах опухоли наблюдаются некрозы и выраженная мононуклеарная реакция. На 1 мм от проксимального края видимой инвазии не наблюдается внутристеночного роста опухоли. (Рис. 2). Метастазов аденокарциномы в лимфатических узлах и жировой ткани не выявлено.

Микропрепарат слизеобразующей аденокарциномы ПК

Рис. 2
при прорастании всей толщины стенки.
Окраска гематоксилин-эозин. Увеличение 10 х 20.
А. Первый срез — в препарате лицо аденокарциномы.
Б. Срез на 5 мм — выявлено отсутствие опухолевых изменений.
Такие данные были получены и при аденокарциноме, и при плоскоклеточном раке ПК. Приведем наблюдение, свидетельствующее о распространении опухолевого роста по кишке в проксимальном направлении. Мужчина 73 года, рак ПК, выполнена передняя резекция ПК. Гистологическое исследование № 869−870; 871−882. Макропрепарат: опухоль 5 см с кратером, циркулярно охватывающая просвет кишки, прорастание всех слоев кишки и прилежащей жировой ткани, участки абсцедирования.
Микроскопическое исследование: аденокарцинома различного уровня дифференцировки. На расстоянии 5 мм от видимой опухоли — аденокарцинома в подслизистом и мышечном слоях, с абсцессами (рис. 3). На срезах через 10 мм от видимого края новообразования опухолевого роста не обнаружено.
 |  |
| А | Б |
Рис. 3. Микропрепарат аденокарциномы ПК различной степени дифференцировки
с прорастанием всех слоев кишки.
Окраска — гематоксилин-эозин. Увеличение 10 х 20.
А. Первый срез — в препарате четко виден край аденокарциномы.
Б. Срез через 5 мм — в слизистом слое видны признаки опухолевого роста.
Приведем еще один случай, который очевидно указывает на распространение опухолевого роста по кишке в проксимальном направлении. Женщина 73 лет с раком ПК, которой была выполнена резекция ПК по Гартману. Макропрепарат: экзофитная опухоль размером 5 х 5 см, прорастание всех слоев кишки, регионарные лимфоузлы не определяются.
Микроскопическое исследование подтвердило наличие аденокарциномы разной степени дифференцировки с очагами в слизистой оболочке, подслизистом слое и жировой клетчатке, внутриорганные лимфатические узлы содержат опухолевые эмболы. На срезах в 5 и 15 мм аденокарцинома была обнаружена на всех образцах.
На срезах в 20 мм от видимого края опухоли — одиночная структура аденокарциномы на границе мышечного слоя и клетчатки. На других двух ступенчатых срезах этого уровня опухолевого роста уже нет (рис. 4). На всех трех ступенчатых срезах в 25 мм от края ракового новообразования опухолевого роста нет.
 |  |  |
| А | Б | В |
Рис. 4. Микропрепарат аденокарциномы ПК разной степени дифференцировки
с прорастанием всей толщи стенки кишки.
А. Первый срез — в препарате четко видно край аденокарциномы.
Б. Срез на 20 мм — в слизистой оболочке зафиксированы признаки опухолевого роста.
В. Срез через 25 мм — признаков опухолевого роста нет.
Рак прямой кишки. Инвазия опухоли. Обсуждение результатов исследования
Полученные данные исследований однозначно показывают, что раковая инвазия в проксимальном направлении от верхнего видимого края опухоли ПК имеет очень ограниченную тенденцию к распространению, в основном не выходя за пределы контуров макроскопического «ракового узла» или прорастая в стенку кишечника не более чем на 5 мм от него. Лишь в 23,5% случаев были зафиксированы случаи проксимального распространения ракового поля, причем максимальная зарегистрированная инвазия составила 20 мм от видимого края опухоли ПК.
Вопреки ожиданиям не выявилось повышенной тенденции к внутристеночному росту при низкодифференцированной аденокарциноме, слизистых и плоскоклеточных формах рака ПК. Следовательно, отступление от верхнего края опухоли на 4−5 см в проксимальном направлении с онкологических позиций вполне оправдано и нет необходимости удалять здоровую и функционально полноценную часть кишки. Однако нужно учитывать, что уровень пересечения кишки выше опухоли во многом определяется высотой перевязки основного кровеносного сосуда, которым для этой зоны является нижняя брыжеечная артерия, особенностями кровоснабжения конкретного участка кишки и вовлеченностью в онкопроцесс лимфатического аппарата. Намечая линию пересечения сигмовидной или нисходящей части ободочной кишки, нужно учитывать эти обстоятельства и по возможности бережно, экономно относиться к удалению этого отдела толстой кишки, помня, что инвазия опухоли по стенке кишки незначительна.
Таким образом, инвазия злокачественного образования в проксимальном направлении от видимого края опухоли в области ПК встречается в 23,5% случаев и не превышает длину в 20 мм. В большинстве случаев «раковое поле» ограничивается контурами основного новообразования или распространяется не более чем на 5 мм от него.
Оперативное вмешательство, включающее пересечение кишки на 4−5 см выше проксимального края обнаруженной раковой опухоли, является онкологически обоснованным, учитывая распространение «ракового поля» по кишечной стенке. Однако объем хирургического вмешательства будет зависеть от особенностей кровоснабжения затронутого участка кишечника, вовлечения лимфатических узлов в процесс и других факторов.
Клинический случай 2

Пациент С., 65 лет. Диагноз: мультицентрический синхронный рак толстой кишки. Рак поперечной ободочной кишки 0-IIa+IIc. Состояние после эндоскопического удаления раннего рака восходящей ободочной кишки 05.2017 (высокодифференцированная аденокарцинома в аденоме, pG1, m3, L0, V0, R0).
У пациента была обнаружена опухоль поперечной ободочной кишки, растущая латерально, размером 2,0×1,5 см, негранулярного типа. Гистологическое исследование показало умеренно дифференцированную аденокарциному в аденоме (рис. 6).

При анализе, проведённом профессионалом Ю. Сайто, было установлено, что структура поверхности опухоли соответствует IV типу по классификации S. Kudo, что указывает на инвазию только в поверхностный слой подслизистой оболочки sm1 (рис. 7).
Следующий этап — лечебный. Была выполнена эндоскопическая резекция слизистой оболочки с опухолью с диссекцией в подслизистом слое ESD (рис. 8, 9,


10). В ходе морфологического анализа удаленной опухолевой ткани в едином блоке было подтверждено, что рост аденокарциномы происходит в пределах собственной слизистой оболочки без признаков глубокой инвазии (рис. 11).


На ЯОКОБ был накоплен опыт диагностики и лечения пациентов с ранними формами рака ободочной и прямой кишки. С 2014 по 2017 год с применением узкоспектральной эндоскопии и анализа структуры опухоли по классификации S. Kudo было обследовано и пролечено 91 пациент с ранними формами колоректального рака с использованием эндоскопических методов.
Возраст пациентов составил от 47 до 83 лет. Из них 69 пациентам выполнена эндоскопическая резекция слизистой оболочки с опухолью (EMR), 23 пациентам — эндоскопическая резекция слизистой оболочки с диссекцией в подслизистом слое (ESD). По результатам послеоперационного морфологического исследования глубокая инвазия (в глубокий подслизистый или мышечный слой) была выявлена у 5 (5,5%) пациентов после эндоскопического удаления опухоли, которая была первоначально оценена как поверхностный рак (m или sm1). При динамическом наблюдении данной группы пациентов в период от 1 года до 3 лет рецидив рака был выявлен у 3 (3,3%) пациентов.
Их нужно знать в «лицо» — кишечные гельминтозы

Мы часто обсуждаем заболевания, инициируемые вирусами, бактериями и грибами. Проблемы СПИДа, гепатита, туберкулеза и гриппа хорошо известны. Однако не менее серьезными могут быть болезни, вызванные гельминтами, приводящими к одному из самых распространенных паразитарных заболеваний человека – гельминтозу.
Термин «гельминтоз» (от латинского Helminthos – червь) был впервые введен Гиппократом, который детально описал клинические проявления заражения различными гельминтами. При инвазии гельминтами возникают сложные взаимодействия между паразитом и хозяином, имеющие склонность к хроническому течению. Симптоматика гельминтозов разнообразна: от отсутствия симптомов до крайне тяжелых форм, угрожающих жизни пациента.
На сегодняшний день на территории России известно около 70 видов гельминтов, которые могут вызывать заболевание у человека. Ежегодно в Российской Федерации регистрируется свыше 2 млн. больных гельминтозами (это и свежие заражения и более или менее давно заразившиеся). Наиболее поражены дети.
Согласно данным монитора по гельминтозам в Гатчинском районе, зафиксированы следующие случаи:
В 2004 году: 38 случаев аскаридоза, 371 случай энтеробиоза, 5 случаев дифиллоботриоза
В 2005 году: 19 случаев аскаридоза, 151 случай энтеробиоза и 4 случая дифиллоботриоза.
В 2006 году: 7 случаев аскаридоза, 149 случаев энтеробиоза и 4 случая дифиллоботриоза.
В 2007 году: 9 случаев аскаридоза, 118 – энтеробиоза и 6 – дифиллоботриоза.
Учитывая глобальность проблемы, возникает вопрос: какую опасность представляют паразиты для человеческого здоровья? Ответ на этот вопрос станет более понятным, если рассмотреть изменения, которые вызывают гельминты в организме человека.
В первую очередь, следует отметить, что наиболее распространенным «местом жительства» гельминта является кишечник человека. Для поддержания жизнедеятельности кишечные гельминты используют содержащиеся в просвете кишечника питательные вещества, тем самым как бы «обворовывая» человека-хозяина, нарушая сбалансированный процесс пищеварения зараженного лица. Гельминты также могут вызывать механическое поражение тканей, на которых паразитируют, что может сопровождаться воспалительными явлениями и нарушением функции органа. Существенное значение имеет хроническая микрокровопотеря из поврежденных стенок кишечника, которая иногда становится причиной развития анемии.
Влияние гельминтов на организм связано не только с поражением органов, где они обитают, но и с общими последствиями для здоровья пациента. Основой этого воздействия являются аллергические и токсические реакции, вызванные их метаболическими продуктами. Особенно выражены аллергические реакции в остром периоде заболевания. Симптомы аллергии могут проявляться кожными высыпаниями различного характера, болями в мышцах и суставах, увеличением лимфатических узлов, дискомфортом или болями в животе, а также увеличением печени и селезёнки. При остром течении могут наблюдаться аллергический миокардит, эозинофильная пневмония, менингоэнцефалит, энцефаломиелит, гепатит и сбои в свертываемости крови.
Токсический эффект гельминтозов проявляется в снижении аппетита, нарушении всасывания питательных веществ в кишечнике, задержке роста, а также отставании в умственном и физическом развитии зараженного человека.
Их нужно знать в «лицо».
Среди множества гельминтозов наиболее распространены такие заболевания, как энтеробиоз, аскаридоз и трихоцефалез.
Энтеробиоз – гельминтоз, который характеризуется явлениями перианального зуда и кишечными расстройствами. Его возбудителем является острица – мелкий гельминт белого цвета, длина самок 9-12мм, самцов–3-4мм.
Подвержены заболеваниям, как правило, 90-95% школьников и детей, посещающих детские организации. Острицы обычно обитают в нижних отделах тонкого кишечника, слепой кишке и начальных участках ободочной кишки. Самки остриц, когда откладывают яйца, спускаются в прямую кишку и выходят наружу, чтобы отложить яйца в области перианальных складок.
Находясь на поверхности кожи, они выделяют секрет, который вызывает интенсивный зуд. Заражение происходит через проглатывание зрелых яиц остриц с пищей, вдыхание пыли или при самозаражении с помощью загрязненных яиц рук больного. Несмотря на то что острицы живут около месяца, частое повторное заражение приводит к затяжному течению энтеробиоза.
Аскаридоз – гельминтоз, который характеризуется в ранней фазе наличием аллергического синдрома с признаками поражения органов дыхания, в поздней фазе – поражением органов пищеварительной системы.
Аскаридоз вызывается веретеновидным гельминтом – аскаридой человека. Длина самцов составляет 15-25 см, а самок – 25-40 см.
Во внешнюю среду незрелые яйца попадают с выделенным калом. В патогенезе аскаридоза важное значение имеет фаза миграции, так как в это время вышедшая из яйца личинка, пробуравливая слизистую оболочку кишечника, попадает в кровоток. С током крови личинка достигает легких, печени и других органов, вызывая в них патологические изменения.
Трихоцефалез – это хроническое гельминтозное заболевание, отражающее нарушения функции пищеварительной системы и анемию. Возбудителем трихоцефалеза является власоглав. Длина тела самок составляет 35-55 мм, а самцов – 30-45 мм.
Гельминт паразитирует на слизистой толстого кишечника, высасывая кровь из сосудов стенки кишечника. Источником инвазии служит больной человек.
Заражение человека происходит при проглатывании инвазионных яиц власоглава с загрязненными почвой пищей и водой, чаще с овощами, ягодами, выращиваемыми на почве, удобренной фекалиями людей, возможно и через грязные руки. Встречаются случаи повторного заражения, особенно у детей.
Пациенты обычно жалуются на общее недомогание, повышенную утомляемость, раздражительность, слюнотечение, тошноту, рвоту и тупые боли в области живота. При паразитировании власоглава в червеобразном отростке возможны приступы аппендикулярной колики, а также развитие аппендицита при вторичной инфекции. Часто отмечаются запоры или их чередование с поносами. Иногда наблюдается умеренная анемия.
При интенсивной инвазии у ослабленных детей наблюдаются выпадение прямой кишки (вследствие сильного поноса), эпилептиформные припадки. Инвазия власоглавами может протекать бессимптомно при слабой интенсивности поражения.
Другие формы гельминтозов:
Дифиллоботриоз – гельминтоз, вызванный паразитированием в кишечнике человека широкого лентеца, крупнейшего ленточного гельминта. Клиническая картина дифиллоботриоза характеризуется умеренными расстройствами желудочно-кишечного тракта, в тяжелых случаях могут возникнуть осложнения со стороны сердечно-сосудистой и нервной систем, а также развитие гиповитаминоза В12 и тяжелой анемии. Человек, вместе с рыбоядными животными (собаками, свиньями и др.), является окончательным хозяином паразита, промежуточным хозяином выступают различные виды рачков-циклопов, а добавочным хозяином – пресноводные рыбы (щука, налим, окунь, лосось и др.). Заражение происходит при потреблении сырой или не термически обработанной рыбы, содержащей личинок дифиллоботриид.
Описторхоз — биогельминтоз, вызываемый паразитированием в печеночных ходах и в протоках поджелудочной железы гельминта — кошачьей (сибирской) двуустки. Окончательными хозяевами паразита являются человек, кошка, собака, пушные звери; промежуточный хозяин — пресноводный моллюск – битиния, дополнительные хозяева — карповые рыбы (плотва, лещ, сазан и др.). Заражение происходит при употребление в пищу недостаточно термически обработанной рыбы.
Трихинеллез – острое заболевание людей и животных, вызванное паразитированием половозрелых и личиночных стадий круглого гельминта – трихинеллы. Инвазия происходит при потреблении недостаточно термически обработанного мяса зараженных животных (свиней, медведей, кабанов). Тяжесть симптоматики определяется интенсивностью инвазии; обычно наблюдаются отек лица, высокая температура, сильные боли в мышцах, сыпь. В тяжелых случаях заболевание может сопровождаться миокардитом, аллергическим поражением легких, центральной нервной системы и сосудистой системы.
Эхинококкозы — хронически протекающие гельминтозы, которые вызываются гельминтами семейства тениид.
Существуют биогельминтозы, включая альвеококкоз и эхинококкоз. Паразитирование личиночных стадий эхинококков в человеческом организме приводит к возникновению однокамерных или многокамерных кист паразита и нарушению функций органов, в которых развивается паразит. Наиболее частыми местами локализации является печень и легкие, но возможны поражения и других органов (мозг, почки, сердце), как первично, так и из-за последующего метастазирования. Эхинококкоз может сопровождаться серьезными осложнениями, что иногда приводит к инвалидности или летальному исходу. Обычно случаи эхинококкозов выявляют на поздних стадиях, спустя несколько лет после начала заболевания.
Природная очаговость характерна для альвеококкоза. Окончательными хозяевами этого гельминта служат дикие псовые (лисицы, песцы, волки), а также домашние собаки. Промежуточными хозяевами являются различные виды грызунов, в основном полевки. Человек может заразиться альвеококкозом, проглатывая яйца паразита, которые могут находиться на диких ягодах или шкурах лисиц, песцов и шерсти собак.
Эхинококкоз сохранил гораздо меньше черт природноочагового заболевания в связи со значительным или полным уничтожением его диких хозяев (волка и крупных копытных) в лесостепных и степных районах. В настоящее время основную опасность в распространении гельминта представляют зараженные собаки и сельскохозяйственные копытные (особенно овцы, интенсивно обменивающиеся гельминтом с собаками).
Факторы риска.
Из числа факторов, воздействующих на уровне индивида, первостепенную роль играет наличие или отсутствие гигиенических навыков. Соблюдение элементарных правил личной гигиены резко уменьшает вероятность заражения гельминтозами, передающиеся через грязные руки (энтеробиоз, аскаридоз, трихоцефалез, эхинококкоз и др.), немытые овощи, зелень, ягоды (аскаридоз, трихоцефалез), возможно, иногда сырую воду (аскаридоз, трихоцефалез).
Пищевая культура человека играет значительную роль в его жизни. Многие предпочитают есть мясо, которое недостаточно приготовлено. Такие люди подвергаются повышенному риску заражения тениями и трихинеллезом. Употребление строганины (тонко нарезанной сырой замороженной рыбы) может привести к заражению описторхозом и дифиллоботриозом, возникающим при определённых обстоятельствах. Кулинары и домохозяйки особенно подвержены тениидозам и трихинеллезу, поскольку часто пробуют сырой фарш в процессе готовки.
Методы профилактики.
Профилактика гельминтозов включает комплекс мероприятий по выявлению больных, их лечение, обеспечение условий жизни, быта и производства, исключающих распространение этих болезней, охрану и оздоровление окружающей среды от возбудителей.
Гельминтозы классифицируются на три категории в зависимости от их биологического цикла развития и путей заражения: геогельминтозы, биогельминтозы и контагиозные.
Возбудители геогельминтозов (аскарида, власоглав) развиваются с откладыванием яиц и их созреванием преимущественно в почве, заражение человека происходит при проглатывании инвазионных яиц или путем активного проникновения личинок из почвы через кожу. Основные профилактические мероприятия направлены на охрану почвы от фекального загрязнения. В качестве удобрения следует применять только фекалии, обезвреженные компостированием или другими способами. Большое значение имеет санитарное просвещение.
Защита от дифиллоботриоза требует усилий по охране водоёмов от загрязнений, надзора за санитарными и ветеринарными нормами, а также правильной кулинарной обработкой мяса и рыбы.
Группа контагиозных гельминтов, как острая аскарида, представляет опасность при непосредственном контакте с инфицированными или через предметы быта (игрушки, книги и пр.). Профилактика инфекционных гельминтозов включает меры по чистоте источников инвазий и предотвращение распространения возбудителей (санитарные и гигиенические мероприятия).
Инвазия всей толщины мышечной оболочки кишечника
Слизистая оболочка кишечника является основным входом для различных патогенных и условных патогенов, а также первой точкой контакта с множеством потенциальных антигенов (эндотоксинами, вирусами, протеогликанами и др.) [1]
Одним из малознакомых паразитарных заболеваний является бластоцистоз. Исследования, проведенные C.H. Zierdt в 1967, 1973, 1988 и 1991 годах, впервые выявили протозойную природу бластоцист, установили их таксономию и представили доказательства их возможной роли в возникновении оппортунистической инфекции — бластоцистоза у людей с иммунной недостаточностью, научно называемого болезнью Зиердта-Гаравелли.
В последние годы в РФ отмечается напряженная эпидемиологическая обстановка по паразитарным болезням [2]. Среди микроорганизмов, вызывающих патологические процессы, стали чаще выявляться различные виды условно-патогенных возбудителей. В стране ежегодно регистрируются более 1,3 миллионов больных различными паразитозами, среди которых отмечается рост заболеваемости кишечными протозоозами [3]. В связи с этим особую актуальность приобретает широко распространенная «новая» протозойная инвазия — бластоцистоз, обусловленная паразитированием преимущественно в толстой кишке простейших Blastocystis spp.
В рамках нашего исследования было обследовано 263 свиньи с ферм Ульяновской области. Эксперименты проводились на лабораторных мышах, не линейных, массой от 23 до 25 граммов, которые содержались в условиях с темперной стабильностью (20-25°С) и равным освещением.
Определив патогенность штаммов Blastocystis spp. методом внутрибрюшинного заражения лабораторных животных, далее мы использовали модель кишечного бластоцистоза K.T. Moe (1997) в модификации Н. И. Потатуркиной-Нестеровой Другие методы заражения бластоцистами экспериментальных животных, такие как внутримышечный и интрацекальный, по нашему мнению, не позволяют воспроизвести данное заболевание адекватно его естественным условиям возникновения и развития, когда простейшие попадают в организм фекально-оральным путем и основной патологический процесс развивается в кишечнике, который и является основным органом-мишенью при данном заболевании.
У экспериментальных животных, заражённых бластоцистами, наблюдались следующие симптомы: снижение активности, изменение состояния шерсти (стала взъерошенной и тусклой), повышенная пугливость, плохой аппетит, жажда, вздутие живота, потеря массы тела, бледность фекалий и диарея с кровью и слизью.
Спустя 24 часа после инфицирования вакуолярными формами бластоцист у 57,5% подопытных отмечалось уменьшение активности, фекалии становились ахоличными и неформированными.
На третьи сутки патологический процесс развивался в большей или меньшей степени практически у всех животных экспериментальной группы. У них наблюдалось снижение аппетита, жажда, вялость, изменялся характер шерсти (взъерошенная, тусклая), фекалии приобретали жидкую консистенцию.
Кроме указанных признаков, на шестой день эксперимента у 42,5% животных из опытной группы в кале были найдены слизистые примеси, а на двенадцатый день они наблюдались у всех мышей, также у 72,5% подопытных в фекалиях появилась кровь.
Максимальные проявления признаков бластоцистоза регистрировалось на 12 сутки после заражения. В этот период животные становились вялыми, не принимали пищу, но активно пили воду, фекалии имели жидкую консистенцию, были ахоличными, имели примеси крови и слизи.
После определённых сроков развития болезни состояние экспериментальных животных начало улучшаться: фекалии вновь приобрели нормальную консистенцию и цвет, аппетит и активность возобновились, вялость и взъерошенность шерсти исчезла.
Важно отметить, что в ходе эксперимента при микроскопии фекалий всех животных опытной группы (100%) были обнаружены разные формы простейших Blastocystis spp.: наибольшее количество составляли вакуолярные формы (более 10 в поле зрения), несколько меньшее — гранулярные (до 10), при этом амебоидные формы были отмечены лишь у 7,3% заражённых (до 5 в поле зрения).
Таким образом, проведенные исследования показали, что введение per os вакуолярных форм бластоцист приводило к развитию патологического процесса, тогда как исследования K. Suresh, T. Moe (1997) свидетельствуют о том, что экспериментальный бластоцистоз развивается у животных при заражении их цистами данных простейших.
Таким образом, наши исследования показывают, что бластоцистная инвазия может возникать при внедрении в организм вегетативных форм возбудителя. Ключевыми признаками этого протозооза у экспериментальных животных являлись вялость, снижение аппетита, жажда, заметные изменения в шерсти, ахолия фекалий и диарея с примесью крови и слизи. Обнаружение признаков бластоцистной инвазии начиналось уже через 24 часа после заражения. Наибольшее их количество наблюдалось на двенадцатый день от начала эксперимента, затем происходило улучшение состояния животных и их выздоровление.
Опухоль сигмовидной кишки: симптомы и признаки

Согласно данным, проявления онкологических заболеваний усиливаются по мере увеличения размера и распространения злокачественной опухоли. Если патологический процесс локализован в одной области, симптомы могут быть незначительными. Тем не менее, при наличии терминальной опухоли сигмовидной кишки, метастазирующей в другие органы, можно столкнуться с серьезными осложнениями.
- Сильные боли в животе.
- Нарушения в дефекации: понос или запор.
- Кишечная непроходимость.
- Тошнота и рвота.
- Вздутие живота.
- Ощущение переполненности кишечника.
- Наличие крови в стуле.
- Анемия, возникающая из-за длительных кровотечений.
- Отсутствие аппетита.
- Снижение массы тела.
- Нарушение функций органов, поражённых метастазами.
- Депрессивные состояния и апатия.
Если указанные симптомы возникают, необходимо немедленно обратиться к врачу.
Способы диагностики и лечение
Диагностикой злокачественных новообразований занимаются онкологи. Во время консультации врач спросит пациента о симптомах, изучит анамнестические данные для выявления факторов риска и проведет физикальное обследование. Поздние стадии опухоли могут быть заподозрены даже на этапе общего осмотра. Окончательный диагноз ставится по результатам инструментальных и лабораторных исследований.
Перечень назначаемых диагностических процедур:
- Общий анализ крови.
- Ультразвуковое исследование органов брюшной полости.
- Рентгенография с контрастированием.
- Компьютерная и магнитно-резонансная томография.
- Биопсия опухолевой ткани.
- Эндоскопическое исследование кишечника.
Самым важным методом диагностики является биопсия, позволяющая определить гистологический тип опухоли. Также данные КТ и МРТ необходимы для выявления метастазов и определения стадии болезни.
- Хирургическая операция с целью резекции пораженной части кишечника и удаления затронутых лимфоузлов.
- Назначение противоопухолевых средств и лучевая терапия.
- Лечебное вмешательство при осложнениях рака.
- Паллиативный уход для облегчения состояния пациента.
Таким образом, рак сигмовидной кишки, для лечения которого основным методом является операция, представляет собой опасное заболевание, распространённое, преимущественно среди людей пожилого возраста. Ранняя диагностика может существенно улучшить прогноз для пациента.
Вопросы по теме
Каковы возможные причины инвазии всей толщины мышечной оболочки кишечника?
Инвазия всей толщины мышечной оболочки кишечника может быть вызвана различными факторами, среди которых наиболее распространённые — это опухолевые процессы, такие как рак кишечника, а также инфекционные заболевания, например, туберкулёз или амебиаз. В некоторых случаях причиной может стать и неинфекционная воспалительная патология, такая как болезнь Крона, в результате чего происходит утолщение стенки кишечника и потенциальная инвазия. Также следует учитывать механические травмы или состояния, приводящие к повышенному давлению в кишечнике.
Какие симптомы могут указывать на инвазию всей толщины мышечной оболочки кишечника?
Симптомы инвазии всей толщины мышечной оболочки кишечника могут варьироваться в зависимости от причины, но наиболее распространённые включают сильные абдоминальные боли, изменения стула (например, диарею или запоры), потерю аппетита и резкое снижение веса. В некоторых случаях могут наблюдаться также признаки кишечной непроходимости, такие как вздутие, рвота и отсутствие газов. Важно отметить, что при наличии таких симптомов необходимо срочно обратиться к врачу для диагностики и назначения необходимого лечения.
Как проводится диагностика инвазии всей толщины мышечной оболочки кишечника?
Диагностика инвазии всей толщины мышечной оболочки кишечника включает несколько этапов. Сначала врач проводит подробное медицинское обследование и составляет анамнез пациента. Далее могут быть назначены различные методы визуализации, такие как ультразвуковое исследование, компьютерная томография (КТ) или магнитно-резонансная томография (МРТ), которые позволяют оценить состояние стенок кишечника. В некоторых случаях может потребоваться и эндоскопическое исследование с возможностью взятия биопсии для уточнения диагноза. Комплексный подход и использование современных диагностических методов позволяют достичь высокой точности в выявлении патологии.