Перивентрикулярный отек у новорожденного — это состояние, характеризующееся накоплением жидкости вокруг венозных зон мозга, особенно в области перивентрикулярных клеток. Это наиболее распространенное неврологическое заболевание у недоношенных детей и связано с недостаточной зрелостью сосудистой системы и нарушением кровообращения.
Отек может приводить к различным неврологическим последствиям, включая задержку развития и двигательные нарушения. Ранняя диагностика и соответствующее лечение, включая мониторинг и медицинскую помощь, могут значительно улучшить прогноз для ребенка.
- Определение: Перивентрикулярный отек – это скопление жидкости вокруг боковых желудочков головного мозга новорожденного.
- Причины: Может развиваться в результате недостатка кислорода, инфекций, травм при родах или недоношенности.
- Симптомы: Включают неврологические расстройства, нарушения тонуса, судороги и измененное поведение.
- Диагностика: Проводится с помощью ультразвукового исследования мозга и клинического обследования.
- Лечение: Зависит от причины и степени тяжести, может включать медикаментозную терапию и реабилитацию.
- Прогноз: При своевременном лечении возможен положительный исход, однако иногда могут возникать долгосрочные неврологические осложнения.
Перивентрикулярный отек новорожденных
В структуре неврологических расстройств у новорожденных значительное внимание привлекают отклонения в мозговом кровообращении, выраженные как в виде кровоизлияний, так и ишемических изменений. Частота и локализация этих нарушений зависят от степени незрелости морфофункциональной структуры центральной нервной системы, а также несовершенства механизмов регуляции кровотока в мозге. Геморрагические и ишемические поражения могут проявляться в различных сочетаниях.
Среди всех сосудистых нарушений, которые можно выявить с помощью нейросонографии, преобладают периинтравентрикулярные геморрагии, перивентрикулярная и субкортикальная лейкомаляции. Эти состояния представляют собой серьезную проблему в области неонатологии, так как они относятся к основным причинам смертности и возникновения психоневрологических расстройств у новорожденных, особенно среди недоношенных детей. Несмотря на то, что мозг недоношенных новорожденных может лучше противостоять гипоксии, цереброваскулярные повреждения у них возникают значительно чаще из-за большей уязвимости сосудистой системы, которая имеет специфические анатомические и физиологические особенности в зависимости от срока гестации.
Проблемы мозгового кровообращения у новорожденных:
- Периинтравентрикулярныекровоизлияния
- Субарахноидальное кровоизлияние:
- Субдуральное кровоизлияние
- Внутримозговое (очаговое)кровоизлияние
- Кровоизлияние в зрительный бугор
- Кровоизлияние в сосудистоесплетение бокового желудочка
- Кровоизлияние в мозжечок
- Перивентрикулярная лейкомаляция
- Субкортикальная лейкомаляция
- Парасагиттальный некроз
- Поражения зрительных бугров и базальных ганглиев
- Инфаркты головного мозга
- Очаговые ишемические поражения ствола и мозжечка
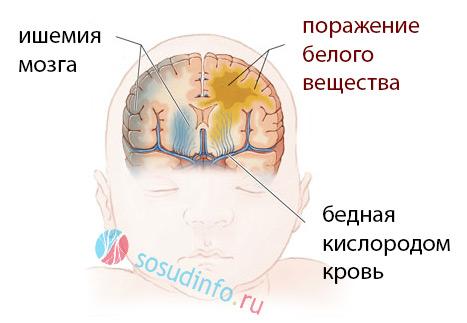
Известно, что кортикальные и субкортикальные участки мозга с 24 до 36-37 недель внутриутробного развития обеспечиваются кровью через лептоменингеальную эмбриональную сосудистую сеть, что защищает эти структуры от повреждений у недоношенных. Наиболее выраженный недостаток кровоснабжения наблюдается в перивентрикулярной области (белое вещество, находящееся на 4-5 см выше боковых желудочков), где располагаются нисходящие кортикальные пути. Глубокие слои перивентрикулярного белого вещества имеют ограниченное кровоснабжение, и поэтому ухудшение кровотока по глубоким артериям у детей с низкой массой тела приводит к снижению притока крови к мозговой ткани — перивентрикулярной ишемии и развитию перивентрикулярной лейкомаляции.
Главный источник перивентрикулярных кровоизлияний (ПВК) — герминальный матрикс (ГМ), существующий в мозге с эмбрионального периода. Впечатляюще он представлен у плодов в 12-16 недель гестации. Активно развиваясь до шестого месяца внутриутробного существования, этот матрикс затем претерпевает инволюцию и к 32-й неделе практически исчезает.
Герминальный матрикс располагается ниже и по бокам от эпендимы, выстилающей дно бокового желудочка, и находится практически над головкой и телом хвостатого ядра. Этот матрикс играет важную роль, поставляя нейроны и глию для коры и подкорковых структур в процессе раннего развития.
Кровоснабжение этой структуры в значительной степени происходит за счет передней мозговой артерии, однако её незрелые сосуды имеют широкий просвет и не обладают базальной мембраной и мышечными волокнами. Скудное количество поддерживающей стромы и высокая активность фибринолиза создают условия для повышенной ранимости сосудов герминального матрикса, особенно у детей с крайне низкой массой тела. Основополагающим для перивентрикулярных кровоизлияний является нарушение ауторегуляции мозгового кровотока, т.е. неспособность поддерживать стабильный уровень кровоснабжения мозга при колебаниях артериального давления. Перивентрикулярные кровоизлияния могут быть как изолированными (субэпендимальными), так и распространяться в желудочки (внутрижелудочковые), затрагивая перивентрикулярную паренхиму (перивентрикулярные) мозга, что связано с образованием вторичного геморрагического инфаркта.
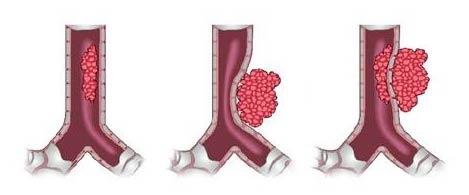
В основу классификации положены степень распространенности кровоизлияния и реакция (расширение) желудочковой системы. В своей работе мы используем классификацию L. Papille et al, которая подразумевает четыре степени кровоизлияния:
- I степень — изолированное субэпендимальное кровоизлияние (субэпендимальная гематома),
- II степень — распространение субэпендимального кровоизлияния в полость бокового желудочка, без его расширения на остром этапе,
- III степень — массовое внутрижелудочковое кровоизлияние с расширением боковых желудочков,
- IV степень — сочетание внутрижелудочкового кровоизлияния и геморрагического инфаркта в перивентрикулярной области.
Данная классификация, по нашему мнению, наиболее полно отражает локализацию и распространенность кровоизлияния, учитывает изменения в размерности желудочков и является удобной для практического применения.
Динамическое ультразвуковое наблюдение за новорожденными высокой группы риска показало, что более чем у 90% случаев перивентрикулярные кровоизлияния возникают и развиваются в первую неделю жизни, особенно между 24 и 72 часами после рождения. У детей с низкой массой тела в 15% случаев кровоизлияния могут проявляться позже — после двухнедельного возраста. Если перивентрикулярное кровоизлияние происходит позже, оно, как правило, имеет доброкачественное течение, а риск осложнений становится незначительным. Зафиксированы случаи внутриутробной диагностики таких нарушений.
Эхографическая характеристика перивентрикулярных кровоизлияний
При ПВК I степени (субэпендимальное кровоизлияние) наблюдается гиперэхогенное округлое образование с четкими границами в области головки хвостатого ядра, каудо-таламической вырезки или межжелудочкового отверстия. При этом увеличения размера бокового желудочка не отмечается, хотя при большом размере гематомы возможно изменение формы бокового желудочка с той стороны, где произошло кровоизлияние.
ПВК II степени. Наряду с гиперэхогенными участками в области головки хвостатого ядра или межжелудочкового отверстия, в полости еще нерасширенного бокового желудочка, нередко с обеих сторон, определяют дополнительные гиперэхогенные структуры, которые связаны с сосудистыми сплетениями и деформируют их. При этом отмечают исчезновение каудо-таламической вырезки за счет дополнительных эхосигналов от сгустка крови.
Для ПВК II степени характерно наличие расширенных, ассиметричных и неровных по контурам сосудистых сплетений, что позволяет произвести диагностику.
При ПВК III степени гиперэхогенные структуры (кровяные сгустки) видны в расширенных боковых желудочках; в 85% случаев они наблюдаются с обеих сторон. В тяжелых случаях образуются сгустки, принимающие форму желудочков (тампонада). В III и IV желудочках такие сгустки фиксируются значительно реже.
ПВК IV степени. Тромб, образовавшийся в боковом желудочке при ПВК III степени, может явиться причиной нарушения венозного оттока через ветви терминальной вены, расположенной перивентрикулярно. Это приводит к венозному инфаркту, что и является основным фактором в развитии перивентрикулярных поражений.
Это кровоизлияние характеризуется присутствием сгустка крови внутри желудочков, расширением этих структур и геморрагическим инфарктом в перивентрикулярной зоне. Этот инфаркт проявляется как гиперэхогенное образование с четкими краями и может находиться над передним рогом, телом или около заднего рога бокового желудочка. ПВК IV степени чаще всего (96-98% случаев) бывает односторонним. В 15-23% наблюдений отмечается увеличение кровоизлияния с переходом от субэпендимального к паренхиматозному в течение первой недели жизни.
При динамическом сканировании (ежедневно на первой неделе жизни, далее 1 раз в неделю после 7 дня жизни) ПВК I степени сохраняется до двух-трех месяцев жизни, меняясь по структуре и эхогенности и уменьшаясь в размерах. В 52% гематома бесследно исчезает, или на ее месте, в 48% случаев, в течение 2-4 недель, образуется субэпендимальная псевдокиста (СК), особенностью которой является отсутствие субэпендимальной выстилки. Как правило, субэпендимальная псевдокиста редуцируется к 6-9 месяцам жизни.
Рассасывание внутрижелудочковых сгустков после ПВК II, особенно III степени, происходит постепенно, часто в течение 5-6 недель. В области паренхиматозного кровоизлияния при ПВК IV степени в 75-82% случаев на 24-36 сутки жизни формируется порэнцефалическая псевдокиста, связанная с боковым желудочком.
Наиболее характерным осложнением ПВК III-IV степени является увеличение боковых желудочков, величина и распространенность которого зависят от тяжести заболевание. Субкомпенсированная дилатация может развиваться в течение 1-3 недель и встречается у 48% детей с ПВК III степени. Обычно при выписке из стационара удобно определить, было ли данное расширение временным, персистирующим или прогрессирующим с вероятным развитием внутренней гидроцефалии. Полная или частичная окклюзия судится по расширению других отделов ликворной системы.
Перивентрикулярная лейкомаляция (ПВЛ) — ишемический инфаркт белого вещества головного мозга вокруг наружных углов боковых желудочков. До недавнего времени диагноз ПВЛ являлся заключением только патоморфологов, поскольку клинической симптоматики, указывающей на поражение перивентрикулярной области у детей раннего возраста, не существует.
Патоморфологическая картина при перивентрикулярной лейкомаляции демонстрирует небольшие участки размягченной мозговой ткани, расположенные перед передними рогами, вблизи латеральных углов боковых желудочков и латерально задних рогов. Иногда через несколько недель после ишемического инсульта обнаруживаются кальцификация и глиоз, которые оставляют так называемый «перивентрикулярный шрам», в других случаях образуются одиночные или множественные полости (псевдокисты), которые могут со временем исчезнуть, вызывая вторичное расширение желудочков и субарахноидального пространства. В 25% случаев ПВЛ сочетается с очаговыми кровоизлияниями. В 25% наблюдений отмечаются вторичные кровоизлияния в некротизированные участки ткани с образованием геморрагических инфарктов, а также ПВК.
На эхограмме в коронарной и парасагиттальной плоскостях острая (начальная) фаза ПВЛ характеризуется значительным повышением эхогенности перивентрикулярных зон с обеих сторон, более выраженным в области тел и задних рогов боковых желудочков. Реже отмечают повышение эхогенности над передними рогами.
Иногда пораженный участок имеет изоэхогенность с сосудистым сплетением, отделяясь от бокового желудочка лишь тонкой полоской ликвора. ПВЛ имеет симметричный характер, то есть всегда двусторонний. Ультразвуковая диагностика на этой стадии проблематична, так как увеличение эхогенности может быть связано со специфическими особенностями васкуляризации и неполной миелинизацией перивентрикулярных зон у недоношенных. Наиболее вероятно развитие ПВЛ, если при повторной проверке через 10-14 дней выраженная эхогенность в перивентрикулярной области сохраняется. Спектральная допплерография может помочь дифференцировать между острой фазой ПВЛ и нормальным ореолом повышенной эхогенности.
На поздней эхографической стадии ПВЛ наблюдается кистозная дегенерация на месте высокой эхогенности. Эти кисты не выстланы эпителием, и может происходить их слияние, образующее более крупные полости. В такой ситуации часто фиксируется минимальное или умеренное расширение желудочковой системы, в основном боковых желудочков за счёт передних рогов и тел.
Далее, в течение 6-8 недель, кисты спадаются, замещаются рубцовой тканью и вызывают вторичную атрофию вещества головного мозга. При атрофии боковые желудочки не теряют свои обычные очертания, но становятся более округлыми в области передних рогов и тел. При этом не отмечают эхографических признаков окклюзии ликворных путей.
Субкортикальная лейкомаляция (СКЛ) развивается в результате нарушения кровообращения в подкорковых областях мозга из-за патологии лептоменингеальных сосудов, что происходит в заключительном триместре беременности. На эхограммах на ранних этапах видно, что мозговая ткань отекает, отмечается диффузное повышение эхогенности тканей мозга и снижение (или отсутствие) пульсации сосудов. В дальнейшем, обычно в течение двух недель, на фоне этого отека формируются участки повышенной эхогенности, не имеющие четких границ. К концу месяца в мозговом веществе появляются многочисленные мелкие кисты, а желудочковая система может немного расширяться, также не редкость расширение субарахноидального пространства.
Достаточно просто выявить дилатацию желудочков и асимметрию при ультразвуковом исследовании. При наличии сомнений необходимо проведение повторного исследования через какой-то промежуток времени. Одной из наиболее частых причин дилатации является врожденный стеноз сильвиева водопровода.
Агенезия мозолистого тела представляет собой еще одну распространенную врожденную аномалию, при которой наблюдается гидроцефалия. Это состояние приводит к значительному смещению боковых желудочков и переднему смещению III желудочка.
- Субэпендимальное кровоизлияние отображается в виде одного или нескольких гиперэхогенных участков, располагающихся под боковыми желудочками, лучше всего выявляется в поперечных срезах на уровне передних рогов. Для подтверждения диагноза проводятся сагиттальные сканирования, так как кровоизлияние может быть двусторонним. Это считается первой степенью кровоизлияния.
- Внутрижелудочковое кровоизлияние в нерасширенные желудочки отражается в виде дополнительных эхоструктур на фоне анэхогенных желудочков, которые соответствуют сгусткам крови. Если расширения желудочков не наблюдается, это указывает на вторую степень кровоизлияния.
- Внутрижелудочковое кровоизлияние в расширенные желудочки относится к III степени кровоизлияния.
- Внутрижелудковое кровотечение, сопровождающееся кровоизлиянием в мозговое вещество, отображается как участки повышенной эхогенности в мозговой структуре. Это признак IV степени кровоизлияния, наиболее выраженной.
- Осложнения кровотечений: при I и II степенях крови, как правило, реабсорбируются на первой неделе жизни, однако более тяжелые формы (III и IV степени) могут привести к постгеморрагической гидроцефалии и рассасыванию ткани с образованием кист в полушариях головного мозга. Это может быть связано с задержкой развития и неврологическими симптомами.
- Некроз мозговой ткани, который определяется как гипоэхогенная зона с нечеткими границами, располагающаяся боком к боковым желудочкам (перивентрикулярная лейкомаляция).
- Отек мозга способен привести к облитерации желудочков и борозд, при этом структура мозга становится более эхогенной, чем обычно.
- Инфекции мозга могут вызывать изменения эхогенности, в том числе появление мелких гиперэхогенных структур, возникающих в результате кальцификации.
Перивентрикулярный отек у новорожденного является одним из наиболее распространенных неврологических состояний, которые могут возникать в первые дни жизни. Он характерен для недоношенных детей и связан с повреждением миелиновой оболочки нервных волокон в области перивентрикулярной зоны головного мозга. Это состояние может возникнуть вследствие различных причин, включая гипоксию, гипотонию и нарушение мозгового кровообращения.
В клинической практике я сталкиваюсь с перивентрикулярным отеком, который можно диагностировать с помощью нейровизуализационных методов, таких как ультразвуковое исследование мозга. При этом важным моментом является своевременное обнаружение отека, так как его причинами могут быть не только гипоксические повреждения, но и инфекции, например, менингит. Чем раньше мы начнем наблюдение и соответствующее лечение, тем больше шансов у новорожденного на благоприятный исход.
Лечение перивентрикулярного отека требует комплексного подхода, включая поддерживающую терапию, нормализацию гемодинамики и предотвращение дальнейших повреждений мозга. Я акцентирую внимание на том, что важно не только медикаментозное лечение, но и создание оптимальных условий для развития ребенка. Поддержка и наблюдение со стороны медицинских специалистов играют ключевую роль в восстановлении функций нервной системы и минимизации возможных долгосрочных последствий для здоровья новорожденного.
Что происходит в мозге при лейкомаляции?
При лейкомаляции головного мозга в подкорковых структурах формируются очаги некроза, как правило, коагуляционного типа; нервные клетки подвергаются гибели, а их место занимает увеличивающаяся микроглия, аналогично образованию рубцов в других органах. Поскольку нейроны неспособны к размножению, области омертвения мозга не могут быть заполнены, что приводит к образованию кист, что называется кистозной лейкомаляцией.
Свыше половины случаев ПЛ сопряжены с вторичными кровоизлияниями в зонах ишемии и некроза, а Возможны кровоизлияния в желудочки мозга. Важно подчеркнуть, что кора головного мозга у таких пациентов поражается крайне редко из-за хорошего кровоснабжения.
Лейкомаляция начинается в первые дни и продолжается около недели с момента рождения. Возможно и более позднее ее возникновение, обычно связанное с инфекцией или нарушением дыхания у новорожденного ребенка. В этих случаях на фоне уже имеющихся некрозов могут появляться новые, а состояние ребенка будет прогрессивно ухудшаться.
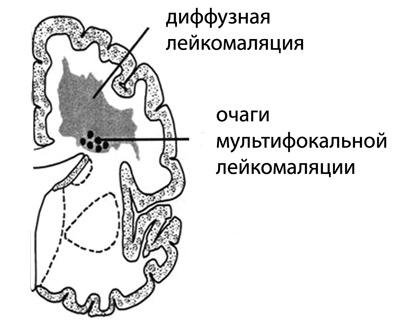
Очаги мультифокальной лейкомаляции размером 2-3 мм обнаруживаются в теменных и лобных долях симметрично вокруг стенок боковых желудочков. Ранее случаются и поражения височных и затылочных долей. Результатом некроза становятся многочисленные кисты различных размеров, разбросанные по подкорковым областям мозга (кистозная дегенерация), число которых со временем увеличивается. При тяжелой форме ПЛ они занимают всю перивентрикулярную область полушарий.
На некроз и образование кист уходит около двух недель, а последующие несколько месяцев в мозге малыша происходит спадение полостей, замещение погибших участков рубцами из нейроглии и необратимая атрофия нервной ткани.

Лейкомаляция на снимках МРТ.
Проявления лейкомаляции
Признаки лейкомаляции разнообразны и часто неспецифичны, но тяжелое гипоксическое повреждение мозговой ткани не может протекать бессимптомно. Выделяют несколько степенейПЛ:
- Легкая степень – признаки нарушения нервной системы могут сохраняться в течение недели со дня рождения;
- Умеренная тяжесть – от 7 до 10 дней, возможны судороги, внутричерепное давление, вегетативные расстройства;
- Тяжелая ПЛ – глубокое повреждение с серьезным угнетением функции мозга, часто наблюдается кома.
Среди симптомов церебральной лейкомаляции можно выделить:
- Повышенную нервно-рефлекторную возбудимость или, наоборот, ее угнетение;
- Судороги;
- Слабый мышечный тонус;
- Тандемные расстройства;
- Параличи и парезы;
- Зрительные нарушения, такие как косоглазие;
- Задержка психомоторного развития, проблемы с интеллектом, гиперактивность и дефицит внимания.
Специалисты особо отмечают, что неврологическая симптоматика в остром периоде и до 3-5 месяцев жизни может быть невыраженной. Примерно у 90% детей после острого периода наступает мнимое благополучие, длящееся до 5 и даже 8-9 месяцев жизни. И только по прошествии такого длительного времени возникают признаки дефицита нервной деятельности на фоне атрофии мозговой ткани.
Вокруг желудочков мозга сосредоточены проводящие пути, ответственные за моторные функции конечностей, поэтому основным признаком церебральной лейкомаляции у детей становится детский церебральный паралич. Однако степень его проявления зависит от размера некроза.
Из-за вовлечения ствола мозга и черепных нервов большая часть детей страдает косоглазием, чаще всего сходящимся, возможны расстройства глотания и дыхания. К шести месяцам проявляется судорожный синдром. Чем больше размер некротических участков и, соответственно, кист, тем резче выражена мозговая недостаточность. Симптоматика зависит от локализации повреждённых участков (двигательные нарушения, проблемы с восприятием, судороги, задержка в психическом развитии).
Тяжелое поражение теменных и лобных долей влечет детский церебральный паралич с одновременным нарушением психического развития. Если вовлечены лишь проводящие пути, отвечающие за иннервацию конечностей, то паралич может не сопровождаться нарушением интеллекта и развития ребенка.
У детей, перенесших перинатальную гипоксию, часто наблюдаются дефицит внимания и гиперактивность при сохранении моторных навыков. Это относительно благоприятный тип патологии, который можно исправить с помощью специальных реабилитационных мероприятий.
Ввиду такой непредсказуемости и разнообразия симптомов, маме бывает сложно разобраться, чего ожидать, когда малыш родился раньше срока и в условиях гипоксии. Если поражение носит умеренный или тяжелый характер, то ребенок не будет развиваться соответственно возрасту – не научится вовремя переворачиваться, сидеть и, тем более, ходить. Речевое развитие затормозится, малыш не сможет гулять, не будет следить за игрушками и проявлять такого характерного для своего возраста любопытства.
Особое внимание следует обратить на гипертонус, который может вызывать болевые ощущения, что делает ребенка беспокойным, плаксивым, нарушает его сон. Грудное кормление может вызвать трудности из-за низкого сосательного рефлекса, повышенной нервно-мышечной возбудимости или атонии.
Недостаточный прирост массы тела, медленный рост, не соответствующий возрасту, а также отсутствие навыков, которые должен развивать растущий ребенок — основные проблемы, с которыми сталкиваются родители детей с легкими или умеренными повреждениями подкорковых участков.
Примерно к году становится заметным неврологический дефицит, развивается церебральный паралич, задерживается психомоторное развитие. После года, когда восстановительный период подходит к концу, в клинике преобладают такие последствия, как задержка психоречевого развития, эмоциональная лабильность, проблемы со сном и вниманием, которые могут быть наряду с более тяжелыми моторными расстройствами (детский церебральный паралич).
Лейкомаляция у взрослых может стать причиной cerebral palsy, гипертонуса, отклонений в умственном развитии и серьезной олигофрении. При благоприятном исходе заболевания взрослые могут не отличаться от своих сверстников.
Клиника, диагностика, прогноз, осложнения перивентрикулярной лейкомаляции
Таким образом, основные клинические симптомы ПЛ в раннем периоде — это: 1) снижение тонуса нижних конечностей, 2) возрастание тонуса в шейных разгибателях, 3) приступы апноэ и брадикардии, 4) гипервозбудимость, 5) псевдобульбарный паралич с бледностью конечностей и 6) судороги.
Во время электроэнцефалографического (ЭЭГ) исследования на ранних стадиях у многих детей наблюдается пароксизмальная активность и подавленное состояние на ЭЭГ. Эти данные используются для прогнозирования последствий ПЛ. Однако специфичность признаков ПЛ на ЭЭГ невысока (включая амплитудные интегрированные данные ЭЭГ).
Наиболее распространенный метод диагностики ПЛ — нейросонографическое исследование (НСГ), которое выполняется через большой родничок в двух плоскостях: коронарной и сагиттальной. Изменение угла наклона датчика позволяет более детально оценить структуру мозга в различных его областях и выявить различные повреждения.
ПЛ относят к группе ишемических поражений перивентрикулярных областей боковых желудочков мозга. На месте ранее выявляемых очагов уплотнения в последующем образуются эхосвободные кистозные образования. Такие изменения называют «кистозной ПЛ». Средний срок образования кист составляет 19 дней с момента рождения.
Наиболее выраженные эхографические признаки ПЛ были зафиксированы на 3-5 день жизни, при этом повышенная эхогенность оставалась заметной на протяжении 10 дней, а затем формировались одиночные или множественные кисты в перивентрикулярных областях мозга (Валид М. А. и соавт., 2005). В ходе НСГ-исследования глубоко недоношенных новорожденных (менее 1500 г) ПЛ наблюдалась у 31,9% детей. Исследователи выявили различные изменения в зависимости от стадии заболевания: участки повышенной эхогенности, кисты (локализованные и распространенные), вентрикуломегалия и церебральная атрофия.
Имеется классификация степеней тяжести ПЛ, основанная на данных нейросонографии (см. выше). Особую трудность представляет диагностика ПЛ в острой фазе, поскольку ореол повышенной перивентрнкулярной эхоплотности в норме присутствует у недоношенных новорожденных. Эти изменения могут исчезать в течение 2—3 недель после рождения и свидетельствовать о каких-либо нарушениях кровообращения в перивентрикулярных областях мозга.
При оценке результатов нейросонографического исследования (НСГ) следует учитывать, что, во-первых, повышенная эхоплотность не является синонимом ПЛ, так как она может означать участки умеренного отека мозга, телэнцефалическую лейкоэнцефалопатию, астроглиоз, перивентрикулярный геморрагический инфаркт, энцефалит и другие патологические состояния. Поскольку в 85% случаев легкой ПЛ наблюдается полное восстановление, это ставит под сомнение возможность трактовать ПЛ как заболевание с обязательным некрозом мозговой ткани.
Справедливо обращают внимание А. Б. Пальчик и Н. П. Шабалов (2000) на то, что «исследующий фиксирует области, где эхогенность либо повышена, либо понижена, а не видит такие изменения, как «отек», «ишемия», «кровоизлияние», «сгусток», «кальцификат», «лейкомаляцию» и прочие термины; на основании нейросонографических данных он лишь может выдвинуть гипотезы относительно причин и характера изменений эхогенности». Кроме того, есть сомнения в корректности относить все случаи перивентрикулярной лейкомаляции (ПЛ) 4-й степени с распространенными поражениями белого вещества полуовальных центров к истинной ПЛ.
Такие поражения более характерны для мультикистозной энцефаломаляции или так называемой «комплексной ПЛ», а не ПЛ с характерными именно перивентрикулярными очагами. Полагаю, что требуется усовершенствование нейросонографической классификации ПЛ. Нейросонография позволила сделать прорыв в диагностику ПЛ, популяризировать данное поражение как одно из наиболее изученных. Вместе с тем необходимо комплексное изучение других пора жений головного мозга, чтобы не заниматься гипердиагностикой ПЛ и не относить любые поражения в белом веществе больших полушарий к ПЛ.
При «некистозной» форме ПЛ исследования с помощью нейросонографии могут не выявлять никаких аномалий в 50—70 % случаев, что делает необходимым проведение многократных исследований (динамического сканирования). Это значительно повышает точность диагностики НСГ при ПЛ.
Особенно много заблуждений возникает при оценке «кист» и «псевдокист» белого вещества мозга, которые специалисты УЗИ не дифференцируют между собой. Поэтому обнаруженные кисты у новорожденных первых дней жизни ошибочно относят к ПЛ, возникшей антенатально. ПЛ — это в основном постнатальный процесс, а в первые дни жизни могут обнаруживаться псевдокисты, представляющие собой порок развития головного мозга, а не истинные кисты. Псевдокисты не имеют никакого отношения к ПЛ, хотя могут сочетаться с ПЛ.
В ходе своих исследований я установил, что повреждения зрительной лучистости наблюдаются с высокой частотой, и рекомендовал для диагностики ПЛ «проведение более детального анализа функции зрения». Радует, что подобные исследования начинают проводиться. Выяснено, что у детей с ПЛ в 100 % случаев возникают офтальмологические осложнения.
У 80,3 % детей с диагнозом ПЛ наблюдается синдром расширенной экскавации диска зрительного нерва, что указывает на процессы транссинаптической нейрональной дегенерации и ретроградной дегенерации аксонов. Поскольку очаги ПЛ преимущественно двусторонние, в подавляющем большинстве случаев (93,4 %) фиксируются билатеральные повреждения диска зрительного нерва. Также были зарегистрированы и другие офтальмологические нарушения: деформация диска зрительного нерва, его атрофия, гипоплазия и т. д. Стоит отметить, что распараллеливания эксавкации зрительного нерва могут встречаться и при других патологических состояниях мозга, затрагивающих зрительную лучистость и стриарную кору. Ранняя диагностика офтальмологических нарушений у новорожденных с ПЛ позволяет своевременно начать лечение, избежать серьезной зрительной депривации и обеспечить более эффективную реабилитацию.
Для диагностики и прогноза формирования ПЛ в настоящее время рекомендуют исследование в сыворотке крови мозгового нейротрофического фактора (BDNF) и специфического белка астроцитарной глии S-100. Повышение концентрации S-100 с высокой достоверностью позволяет прогнозировать развитие тяжелых структурных повреждений мозга, особенно при сочетании ПЛ с ВЖК, когда наблюдалось превышение показателей нормы в 10—12 раз. У новорожденных с ПЛ уровень сывороточной концентрации BDNF низкий.
Прогноз при ПЛ. Согласно моим данным и литературным источникам, при ПЛ страдают, прежде всего, кортико-спинальный тракт, а также зрительная и слуховая лучистости. Последствиями ПЛ могут быть: 1) детский церебральный паралич (чаще всего спастическая диплегия, при тяжелых случаях – квадриплегия), 2) задержка психомоторного развития, 3) зрительные нарушения (проблемы с фиксацией, нистагм, страбизм и др.). Также могут наблюдаться нарушения слуха.
По данным О. Н. Малиновской и соавт. (2005), исходом ПЛ являются: 1) выздоровление (19,5 %), 2) детский церебральный паралич (ДЦП) (80,5 %), 3) судорожный синдром и эпилепсия (37,5 %) и 4) задержка психоречевого развития (66 %). Все дети с задержкой развития страдали ДЦП, причем чем значительнее двигательные нарушения, тем грубее нарушения психоречевого развития. У всех детей с 3 и 4 степенями тяжести по данным
Детский церебральный паралич развивался в результате НСГ. Исходы, такие как полное выздоровление, могут вызвать сомнения, поскольку даже минимальные повреждения мозга при ПЛ сопровождаются нарушениями нервных волокон, их ретроградной дегенерацией, астроглиозом и другими изменениями. Можно предположить, что не все случаи ПЛ, установленные по данным НСГ, могут считаться истинными. В то же время такие осложнения, как эпилепсия, вероятно, связаны с поражениями кортиковых структур и субикулюма гиппокампа, которые крайне чувствительны к гипоксии. Важно различать последствия ПЛ и эффекты других сопутствующих диагностических находок, что представляет собой сложную задачу.
Согласно данным J. Volpe (2003), 10 % выживших сильно недоношенных грудничков (масса до 1500 г) с диагнозом ПЛ страдают детским церебральным параличом, а 50 % в будущем имеют психомоторные нарушения.
При ДЦП по данным НСГ определяют 5 основных типов нарушений: ПЛ (33,1 %), постгеморрагическую порэнцефалию, аномалии развития, кортикальную и субкортикальную атрофию, повреждения базальных ганглиев (Гайнетдинова Д. Д., 2001). ПЛ и ДЦП — это разные нозологические единицы. По моим данным, после перенесенной ПЛ формируются кисты в белом веществе мозга с характерным преобладанием в определенных отделах мозга (см. топографию), в той или иной степени атрофируется белое вещество, а при тяжелой степени поражения гипоплазируются мозолистое тело, кора больших полушарий и расширяются боковые желудочки (возникает вентрикуломегалия).
Существует мнение, что детский церебральный паралич проявляется у всех детей с ПЛ, которые к 6 месяцам скоррегированного возраста не могут удерживать голову. При этом прогноз неврологических нарушений зависит от степени тяжести ПЛ. При ПЛ 1 степени все дети могли передвигаться самостоятельно, при ПЛ 2 степени – 80 % детей могли двигаться как самостоятельно, так и с поддержкой, а при 3 степени только 15 % могли передвигаться самостоятельно, в то время как 45 % не могли передвигаться и сидеть без посторонней помощи.
Для профилактики ПЛ рекомендуется антенатальная диагностика хориоамнионитов с последующим введением матери на 24-31 неделях беременности бетаметазона, положительно влияющего на защитную реакцию плода при воспалении. Важно предупреждать преждевременные роды, не употреблять наркотики (кокаин), диагностировать внутриутробные инфекции, предупреждать пролонгированную гипокарбию при искусственной вентиляции легких и т. д.
Множество исследований подчеркивают значимость фактора некроза опухоли (ФНО) в развитии ПЛ, который вызывает артериальную гипотензию, усиливает интраваскулярное сгущение крови, способствует гибели олигодендроцитов и т. д. В то же время кортикостероиды блокируют синтез ФНО астроглиоцитами и снижают его активность, что позволяет считать их использование в лечении и профилактике ПЛ целесообразным. Тем не менее, есть данные о том, что раннее назначение дексаметазона недоношенным детям при синдромах дыхательной недостаточности (СДР) связано с развитием ПЛ. При проведении ранней терапии дексаметазоном в первые три дня жизни увеличивается частота неврологических осложнений и случаев ДЦП. Поэтому целесообразно применять этот препарат после двухнедельного возраста или использовать альтернативные лекарства (будесонид, пулимикорт) и ингаляционные стероиды (флутиказон, беклометазон).
Для детей, находящихся на искусственной вентиляции легких (ИВЛ), крайне важно отслеживать состав газов крови, так как известно, что гипероксия, гиперкапния и ацидоз являются факторами риска ПЛ. Тактика лечения ПЛ во многом совпадает с мерами при «гипоксически-ишемической энцефалопатии». Это включает применение антиоксидантов, ингибиторов образования кислородных радикалов, блокаторов кальциевых каналов и антагонистов кальция и т. д. Рекомендуется также и известная методика кранио-церебральной гипотермии (охлаждение головы), которая способствует замедлению обменных процессов в головном мозге и снижает риск его ишемического повреждения.
В терапии ПЛ важно использовать препараты, улучшающие мозговое кровообращение (винпоцетин, стугерон, ницерголин) и ноотропы (пирацетам). При респираторном дистресс-синдроме целесообразно назначение препаратов сурфактанта, уменьшающих тяжесть дыхательных расстройств и уменьшающих потребность в ИВЛ, а тем самым снижающих риск возникновения новых очагов ПЛ. В терапии ДЦП, возникших вследствие ПЛ, рекомендуется использование церебролизина (Гайнетдинова Д Д., 2001), обладающего антикласто- генной и антиоксидантной активностью. Все разработки по лечению церебральной ишемии и гипоксически-ишемической энцефалопатии 3-й степени целесообразно применять и при лечении ПЛ.
Последствия заболевания
До начала прогрессирования болезни можно наблюдать нормальное состояние ребенка, которое ничем не отличается от состояния здоровых детей. Тем не менее, затем у него развивается детский церебральный паралич, сопровождающийся характерными симптомами:
- Нарушение сознания.
- Проблемы с глотанием и дыханием.
- Повышение артериального давления.
- Замедление умственного развития и отставание от сверстников.
- Патология центральной нервной системы.
В зависимости от области поражения белого вещества и мозговой оболочки, у ребенка могут присутствовать часть или все перечисленные выше последствия.
Сегодняшние достижения медицины позволяют лечить практически любое заболевание. Однако перивентрикулярная лейкомаляция не всегда поддается лечению. В тяжелых случаях болезни ребенок может остаться инвалидом на всю жизнь, и родителям придется заботиться о поддержании его здоровья.
Важно помнить, что не все преждевременно родившиеся дети становятся инвалидами. Для получения такого диагноза должно сложиться множество факторов. Ключевым моментом является своевременное прохождение курсов медикаментозной терапии и физиотерапии.
Профилактика лейкомаляции
Для минимизации заболевания матери будущего ребенка следует придерживаться ряда правил:
- Соблюдение здорового образа жизни.
- Планирование беременности, что включает отказ от вредных привычек не менее чем за полгода до зачатия.
- Сбалансированное питание будущей матери, богатое витаминами.
- Защита будущей матери от стрессов.
- Внимательное наблюдение медицинскими работниками за состоянием беременности, своевременная постановка на учет и выполнение всех предписаний врача.
- Предотвращение вирусных и инфекционных заболеваний, а при их появлении – незамедлительное обращение к врачу.
Матери нужно понимать последствия, связанные с алкоголизмом и курением. Врачам же необходимо предотвратить случаи недоношенности, проверяя беременных на наличие заболеваний, отклонений или патологий.
Вопросы по теме
Какие факторы могут способствовать развитию перивентрикулярного отека у новорожденных?
Развитие перивентрикулярного отека у новорожденных может быть связано с рядом факторов, включая недоношенность, родовые травмы и гипоксию. Недоношенные дети имеют более высокие шансы на развитие таких состояний из-за не полностью сформированной нейроанатомии и недостаточной зрелости сосудов. Гипоксия, или нехватка кислорода, во время родов также может приводить к повреждению мозга и, как следствие, к появлению отека. Кроме того, инфекции и метаболические нарушения у новорожденных могут усугублять ситуацию.
Каковы потенциальные последствия перивентрикулярного отека для развития ребенка?
Перивентрикулярный отек может иметь долгосрочные последствия для развития ребенка. В зависимости от степени и тяжести отека, возможны нарушения в психомоторном развитии, задержка речи, а также проблемы с координацией. В более тяжелых случаях это может привести к церебральному параличу или другим неврологическим расстройствам. Однако важно отметить, что не все дети, у которых наблюдается перивентрикулярный отек, испытывают серьезные осложнения, и результат может существенно варьироваться в зависимости от индивидуальных условий.
Какие методы лечения существуют для новорожденных с перивентрикулярным отеком?
Лечение перивентрикулярного отека может включать в себя медикаментозную терапию, направленную на уменьшение отека и улучшение кровообращения в мозге. В некоторых случаях может потребоваться применение диуретиков для снижения избыточной жидкости в мозговых структурах. Также важно обеспечить адекватную поддержку терморегуляции и кислородотерапию. Реабилитация, включающая физическую и логопедическую терапию, может помочь в дальнейшем развитии ребенка. Каждое лечение должно быть индивидуально подобрано на основании состояния конкретного пациента.