Плазмоцитарная инфильтрация желудка — это патологический процесс, при котором в слизистой оболочке желудка происходит накопление плазматических клеток. Эти клетки, являющиеся производными В-лимфоцитов, играют ключевую роль в иммунном ответе организма, вырабатывая антитела.
Данный процесс может быть связан с различными заболеваниями, включая воспалительные и инфекционные процессы, и часто ассоциируется с хроническим гастритом или другими формами желудочных расстройств. Плазмоцитарная инфильтрация может приводить к нарушению функции желудка и требует выявления и лечения основной причины, вызвавшей эту патологию.
- Определение: Плазмоцитарная инфильтрация желудка — это патологический процесс, при котором наблюдается накопление плазматических клеток в тканях желудка.
- Причины: Может быть вызвана хроническими воспалительными заболеваниями, инфекциями или аутоиммунными расстройствами.
- Симптомы: Зачастую протекает бессимптомно, но могут возникать боли в животе, диспепсические расстройства и потеря аппетита.
- Диагностика: Основывается на гистологическом исследовании биоптатов тканей желудка и клинических данных.
- Лечение: Направлено на устранение причины инфильтрации и может включать медикаментозную терапию, изменение образа жизни и диету.
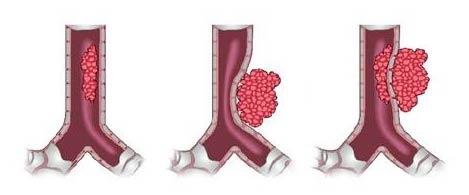
Методы лечения и прогноз выживаемости при инфильтративном раке желудка
Инфильтративный рак желудка считается одной из самых угрожающих форм онкологических заболеваний. Этот вид рака сложно диагностировать на ранних стадиях, а его прогресс может быть стремительным, сопровождающимся метастазированием. Поэтому очень важно знать, как обнаружить данное заболевание своевременно и как его лечить.
К основным факторам, ведущим к возникновению инфильтративного рака желудка, относятся:
- Хронический атрофический гастрит;
- Язвенная болезнь желудка.
Обе патологии вызывают явные и глубокие повреждения слизистой оболочки желудка. Однако злокачественные изменения в тканях могут происходить также под воздействием других вспомогательных факторов:
- Неблагоприятная экологическая обстановка в регионе. Проживание рядом с крупными промышленными предприятиями часто негативно сказывается на здоровье и повышает вероятность развития онкологических заболеваний.
- Неправильное питание. Регулярный дефицит питательных веществ или их избыток ведет к нарушениям в функционировании желудочно-кишечного тракта. Частое употребление консервантов, приправ и пищи крайне высокой или низкой температуры может повреждать слизистую желудка.
- Гормональные нарушения. Такие изменения, особенно после 30 лет, могут привести к трансформации клеток и их неконтролируемому делению.
- Наследственная предрасположенность. Наличие злокачественных опухолей у родственников указывает на повышенный риск заболеть.
- Пониженная иммунная защита.
Обычно причин возникновения инфильтративного рака желудка несколько. Риск развития онкологического заболевания существенно повышается при отсутствии лечения хронического гастрита или не рубцующейся язвы, которые склонны к рецидивам.
Кто входит в группу риска
Наиболее подвержены инфильтративному раку те, кто страдает от постоянных проблем с пищеварительным трактом и не обращается за лечением.
Появление патологии на 15% чаще наблюдается у мужчин. При этом возрастных рамок развития болезни нет. Но у людей с предрасположенностью к онкологическим заболеваниям нередко инфильтративный рак развивается в возрасте до 30 лет.
Плазмоцитарная инфильтрация желудка представляет собой патологический процесс, характеризующийся накоплением плазмоцитов в слизистой оболочке желудка. Эти клетки, являющиеся производными В-лимфоцитов, играют ключевую роль в иммунном ответе организма, вырабатывая антитела. Однако, в случае плазмоцитарной инфильтрации, их избыточное количество может свидетельствовать о хроническом воспалении, которое, в свою очередь, может быть связано с различными заболеваниями желудочно-кишечного тракта.
Являясь признаком хронического гастрита или других воспалительных заболеваний, плазмоцитарная инфильтрация может выявляться при эндоскопических исследованиях и гистологических анализах биопсийного материала. Обычно она сопровождается другими изменениями в слизистой оболочке, такими как атрофия или метаплазия, что требует комплексного подхода к диагностике и лечению. Важно отметить, что своевременная диагностика данной патологии может предотвратить развитие более серьезных заболеваний, таких как рак желудка.
Лечебные тактики могут варьироваться в зависимости от причины инфильтрации. Если плазмоцитарная инфильтрация обусловлена, например, инфекцией Helicobacter pylori, то антибактериальная терапия может быть основным направлением лечения. В других случаях может потребоваться применение противовоспалительных и иммуносупрессивных средств. Комплексный подход, включающий диету и изменение образа жизни, также играет значительную роль в реабилитации пациентов с данной патологией.
Активность и степень хронизации процесса в слизистой оболочке желудка у больных с различными типами хронического гастрита
Введение. Рак желудка занимает одно из главных мест в списке злокачественных заболеваний. В год по всему миру фиксируется около 800 тысяч новых случаев, более 600 тысяч из которых заканчивается летальным исходом [2, 5, 7, 11, 14]. Известно, что рак желудка обычно не появляется на фоне здоровой слизистой оболочки.
Ему предшествуют некоторые предраковые состояния, среди которых главным является хронический гастрит. Согласно различным источникам, хронический гастрит может быть выявлен у 50-80% взрослого населения [4, 6, 8, 9].
Основной характерной чертой воспалительных процессов при хроническом гастрите является мононуклеарная и лимфоплазмоклеточная инфильтрация в слизистой оболочке, которая поддерживает хроническое воспаление в течение длительного времени. Острый воспалительный процесс обычно укореняется гранулоцитарной инфильтрацией, тогда как иммунный – лимфоплазмоцитарной инфильтрацией. Иммунное воспаление является постоянным признаком любого хронического гастрита [1, 3].
Присутствие элементов острого воспаления указывает на активный гастрит, в то время как их отсутствие говорит о неактивном хроническом гастрите.
Цель исследования – изучение активности и хронизации процесса в слизистой оболочке желудка больных с различными типами хронического гастрита.
Материалы и методы. В нашем исследовании принимали участие 118 пациентов с хроническим гастритом, которые проходили лечение в клинике госпитальной терапии Военно-медицинской академии им. С. М. Кирова с сентября 2008 по апрель 2011 года. Все участники были разделены на две группы: первая группа представляла собой больных хроническим атрофическим гастритом, вторая – хроническим неатрофическим гастритом.
Группы сопоставимы по полу и возрасту.
Всего было обследовано 32 больных с хроническим атрофическим гастритом в возрасте от 23 до 82 лет (средний возраст 54,9±4,6 лет) и 86 больных с хроническим неатрофическим гастритом в возрасте от 18 до 76 лет (средний возраст 52,8±3,4 лет). Среди больных хроническим гастритом преобладали пациенты среднего и пожилого возраста (пациенты в возрасте более 40 лет составили 84,8% – 100 обследованных).
Диагностика болезни проводилась на основе характерных симптомов, анамнеза, результатов объективного обследования и данных лабораторных и визуальных исследований. Наиболее значимыми для окончательного диагноза были результаты эзофагогастродуоденоскопии и морфологического анализа.
Эндоскопическое исследование осуществляли с помощью фиброгастродуоденоскопа фирмы «Olympus GIF-Q20» (Olympus, Япония) по общепринятой методике [10]. Выполняли прицельную биопсию из слизистой оболочки тела и антрального отдела желудка. Два кусочка брали из антрального отдела в 1-2 см от привратника и два кусочка – из средней трети желудка по малой кривизне.
Биопсии слизистой оболочки желудка, полученные во время эндоскопии, фиксировались в 10% нейтральном формалине, затем обезвоживались и замораживались в парафине. Срезы толщиной 5 мкм окрашивались гематоксилином и эозином, применялась также штриховая реакция.
Патоморфологические изменения слизистой желудка оценивались согласно Новой международной классификации хронического гастрита [13]. Морфологически документировалась степень и распространенность атрофических изменений. В ходе гистологического анализа биоптатов также оценивались воспалительные изменения слизистой оболочки. Активность гастрита определялась по инфильтрации полиморфно-ядерными лейкоцитами, а степень хронического воспаления – по уровню лимфоплазмоцитарной инфильтрации.
Результаты и обсуждение. Инфильтрация слизистой оболочки желудка полиморфно-ядерными лейкоцитами была оценена у 118 больных хроническим гастритом. Полученные результаты представлены в табл. 1.
Таблица 1. Инфильтрация слизистой желудка полиморфно-ядерными лейкоцитами (ПЯЛ) у пациентов с хроническим гастритом

Из представленных данных следует, что инфильтрация слизистой оболочки желудка полиморфно-ядерными лейкоцитами была обнаружена у 68 больных хроническим гастритом, напротив, у 50 больных инфильтрации слизистой оболочки желудка не обнаружено. При этом она определялась у 20 больных хроническим атрофическим гастритом и у 48 больных хроническим неатрофическим гастритом (у 62,5% и 55,8% соответственно), что свидетельствует об активном воспалительном процессе в слизистой оболочке желудка у большего числа больных. Различия между группами были статистически недостоверными (p>0,05).
Среди исследуемых пациентов у части не наблюдалось полиморфно-ядерных лейкоцитов (37,5% больных с хроническим атрофическим гастритом и 44,2% с хроническим неатрофическим гастритом, 12 и 38 пациентов соответственно), однако различия между группами оказались статистически незначительными (p > 0,05).
Мы проанализировали локализацию воспалительного процесса в слизистой оболочке желудка у пациентов с различными типами хронического гастрита. Результаты представлены в таблице 2.
Таблица 2. Локализация активного воспалительного процесса в слизистой оболочке желудка у больных хроническим гастритом

Степень хронического воспаления слизистой желудка у пациентов с хроническим гастритом оценивали по уровню лимфоплазмоцитарной инфильтрации. Данные представлены в таблице 3.
Таблица 3. Лимфоплазмоцитарная инфильтрация (ЛПИ) слизистой оболочки желудка у больных хроническим гастритом

Выявлено, что лимфоплазмоцитарная инфильтрация слизистой желудка, превышающая допустимые нормы, наблюдалась у большинства участников обеих групп (у 102 пациентов с хроническим гастритом – 86,4% больных). При этом различия в группах оказались статистически значимыми (p < 0,01). Повышенная лимфоплазмоцитарная инфильтрация отмечена у 28 пациентов с хроническим атрофическим гастритом и 74 с хроническим неатрофическим гастритом (87,5% и 86% соответственно), при этом разницы между группами не выявлено (p > 0,05).
Мы также исследовали уровень лимфоплазмоцитарной инфильтрации в зависимости от локализации гастрита. Результаты представлены в таблице 4.
Таблица 4. Локализация повышенной лимфоплазмоцитарной инфильтрации в слизистой оболочке желудка у больных хроническим гастритом

Выводы
- Активность воспалительного процесса в слизистой желудка, отраженная через инфильтрацию полиморфно-ядерными лейкоцитами, значительно чаще наблюдается как у пациентов с хроническим атрофическим гастритом, так и с хроническим неатрофическим (62,5% и 55,8% соответственно). При этом активное воспаление, как у больных хроническим атрофическим гастритом, так и у больных хроническим неатрофическим гастритом, чаще всего локализуется одновременно в слизистой антрума и тела желудка (p < 0,05).
- Обостренная лимфоплазмоцитарная инфильтрация слизистой желудка (хроническое воспаление) встречается значительно чаще как у пациентов с хроническим атрофическим гастритом, так и с хроническим неатрофическим (87,5% и 86% больных соответственно). В обеих группах она локализуется чаще одновременно в антральной части и теле желудка, с достоверными статистическими различиями (p < 0,01).
Плазмоцитарная инфильтрация желудка что это такое
Истинные предраковые изменения слизистой желудка включают дисплазию эпителия. Выделяют три степени дисплазии: легкую, умеренную и выраженную. Наиболее опасной для трансформации в рак желудка считается тяжелая дисплазия. В современном подходе оставлены лишь две степени — лёгкая и тяжёлая.
Дисплазия представляет собой истинную неоплазию, не сопровождаемую инвазивными признаками. Гистологические изменения эпителия, предшествующие опухолевому росту, именуются дисплазией. Она может быть обнаружена как в покровно-ямочном и шеечном, так и в метапластическом эпителии кишечного типа желудка.
Для дисплазии эпителия характерны нарушение гистоархитектоники слизистой оболочки, клеточная атипия и снижение дифференцировки клеток. Признаками нарушения структуры слизистой оболочки являются нарушение формы желез, их ветвление, почкование, тесное расположение. Клеточная атипия эпителия проявляется полиморфизмом, гиперхромностью ядер, увеличением ядерно-цитоплазматического соотношения; снижение дифференцировки клеток — уменьшением секреции, исчезновением дифференцированных клеток (главных, париетальных), а при кишечной метаплазии — уменьшением числа бокаловидных и клеток Панета вплоть до их полною исчезновения.
Цель исследования состоит в оценке степени распространения, характеристик и клеточного состава лейкоцитарных инфильтратов при различной степени эпителиальной дисплазии слизистой желудка.
Определяли степень и характер распространения лейкоцитарных инфильтратов в слизистой оболочке желудка, его клеточный состав при дисплазии эпителия низкой и высокой степени. Исследовали биоптаты желудка, взятые во время гастродуоденоскопического обследования. Парафиновые срезы окрашивали гистологическими и гистохимическими методами. Оценивали площадь инфильтратов по программе «Bio Vizion» с использованием цифрового окуляра USB 5,0. Подсчитывали различные клеточные формы на 500 лейкоцитов, проводили статистическую обработку данных при помощи программы StatSoft 6.0.
Таким образом, предраковые состояния желудка различаются по характеру лейкоцитарной инфильтрации. Распространенность инфильтратов напрямую зависит от активности патологического процесса. Также изменяется клеточный состав лейкоцитарных инфильтратов: с увеличением степени дисплазии растет количество бластов, активированных лимфоцитов, проплазмоцитов и плазмоцитов. Поэтому характеристики лейкоцитарных инфильтратов, их распространение и клеточный состав являются важными аспектами предраковых состояний желудка.
Резюме
Изучено клиническое и морфофункциональное состояние желудка у больных множественной миеломой (ММ). У больных ММ состояние слизистой оболочки желудка меняется в процессе опухолевой прогрессии. Преобладают атрофические изменения, значительно снижена кислотообразующая функция желудка, преобладает декомпенсация ощелачивающей функции антрального отдела.
Выявлены факторы, способствующие этому явлению. Специфическая инфильтрация плазмоклеток опухолью при множественной миеломе довольно редка и наблюдается на поздних стадиях развития опухоли.
Состояние желудка и двенадцатиперстной кишки при множественной миеломе
A.V. Gruzdova, A.A. Grigorenko
Краткое содержание
Изучено клиническое и морфо-функциональное состояние желудка у пациентов с множественной миеломой (ММ). В процессе прогрессирования опухоли наблюдаются изменения в состоянии желудочной слизи у этих пациентов. Преобладают атрофические изменения и гипо- или анцидное состояние, в то время как кислотная функция желудка деградирует, а компенсаторная щелочная функция антральной области нарушается. Установлены причины, способствующие этому.
Специфическое опухолевое клеточное поражение плазмой при множественной миеломе встречается весьма редко и, как правило, фиксируется на поздних стадиях прогрессирования заболевания.
Множественная миелома (ММ) – злокачественное лимфопролиферативное заболевание, характеризующееся инфильтрацией костного мозга плазматическими клетками, наличием моноклонального иммуноглобулина в сыворотке крови и/или моче и остеолитическими поражениями костей [6]. Количество больных ММ постоянно увеличивается, что лишь частично связано с увеличением продолжительности их жизни [1, 3, 4].
Специфические поражения желудка и кишечника, связанные с множественной миеломой, регистрируются весьма нечасто. Средний возраст пациентов с поражениями органов пищеварения миеломой составил 46,3 года, при этом соотношение мужчин и женщин равное 1:1 [2]. Были зафиксированы случаи выявления одиночной плазмоцитомы в толстой кишке [10, 12].
Клинические проявления зависят от месторасположения миеломной опухоли в желудочно-кишечном тракте. Дифференциальный диагноз следует проводить с другими злокачественными новообразованиями и воспалительными псевдоопухолями. Необходимо проведение рентгенологического, радиографического и гистологического исследований. Единственным методом лечения солитарной плазмоцитомы желудочно-кишечного тракта является ее хирургическое удаление.
У пациентов с гемобластозами часто выявляются эрозии и язвы на слизистой оболочке ротовой полости, а также некротические изменения, которые могут возникнуть как следствие присоединившейся инфекции, так и из-за прогрессирования лейкозного процесса. Частота поражений слизистой полости рта у больных онкогематологическими заболеваниями колеблется в диапазоне от 19% до 99% согласно различным исследованиям [2, 8, 9].
Существует множество публикаций, посвященных одним из серьезных осложнений химиотерапии — некротической энтеропатии [5, 7]. В большинстве случаев она возникает во время агранулоцитоза.
В то же время очень мало выполнено работ, посвященных патологии желудка и 12-перстной кишки при ММ. В связи с вышеизложенным целью данной работы явилось изучение особенностей клинического и морфофункционального состояния желудка и двенадцатиперстной кишки у больных ММ.
Материалы и методы
Обследованы 50 больных множественной миеломой, находившиеся на учете у гематолога в Амурской областной поликлинике в 2009 – 2012 гг. Больные ММ были разделены на три группы в соответствии с классификацией B. Durie и S. Salmon (1975): в I группу включено 8 больных ММ в стадиях IА и IIА (из них 5 с солитарной плазмоцитомой) в возрасте 56±4,6 лет, II группу составили 32 пациента в стадии IIIА (средний возраст 58±6,5 лет) и III группу 10 больных в стадии IIIБ (с наличием хронической почечной недостаточности – ХПН) в возрасте 57±6,6 лет.
Эндоскопическое исследование желудка и двенадцатиперстной кишки проводилось при помощи гастроскопа Olympus (Япония). Для оценки морфологического состояния слизистой оболочки желудка и 12-перстной кишки выполнялась целевая биопсия из областей фундального и антрального отделов желудка, а также из зон с наиболее выраженными изменениями, с последующим гистологическим анализом полученного материала. У всех пациентов исследовалась кислотообразующая функция желудка и щелочная способность антральной области с применением внутрижелудочной рН-метрии на базе ацидогастрометра «Гастроскан – 5 М» («Исток-Система», Россия). Измерения pH проводились с помощью рН-метрического зонда в трех стандартных точках — нижней трети пищевода, теле и антральном отделе желудка. Для диагностики хеликобактерной инфекции использовалась биопсия во время эндоскопического исследования желудка и 12-перстной кишки с последующими тестами на уреазу, гистологическими анализами и выделением хеликобактера на питательных средах, а также определение титра антител в крови к антигенам H. Pylori методом ИФА.
Контрольную группу составили 20 человек, сопоставимых по полу и возрасту, не имеющих лимфопролиферативных заболеваний и заболеваний желудка и двенадцатиперстной кишки.
Результаты и обсуждение
У 12 пациентов был установлен отягощенный анамнез по гастродуоденальным заболеваниям, из которых 7 страдали язвенной болезнью 12-перстной кишки. Все эти диагнозы были установлены до подтверждения множественной миеломы. У 5 больных был диагностирован хронический гастрит до подтверждения миеломы (разные варианты, согласно Сиднейской классификации 1990 года, модифицированной в Хьюстоне в 1994 году). Клинические признаки поражения желудка наблюдались у 5 пациентов с обострением язвенной болезни 12-перстной кишки (у 2 из них язвенная болезнь находилась в стадии ремиссии). Болевой синдром в животе являлся ведущим симптомом лишь у 5 пациентов с обострениями язвенной болезни желудка.
Гораздо чаще у этих пациентов отмечался диспептический синдром. Во II группе он диагностирован у 24 больных: тошнота у 20, рвота у 12, метеоризм у 8, изжога у 15 больных. Диспептические расстройства у пациентов этой группы следует объяснять приемом высоких доз глюкокортикоидов и токсическим действием цитостатиков.
Тошнота у всех пациентов фиксировалась после курсов химиотерапии (VMP, PAD, velk+dexa). В III группе желудочная диспепсия также связывается с проявлениями ХПН. В этой группе анорексия наблюдалась у всех 10 больных, тошнота и рвота у 8, изжога у 6 и метеоризм у 6. Тошнота и рвота у пациентов III группы регистрировались на фоне нарастающей азотемии. У больных I группы, не проходивших химиотерапию, диспептические расстройства не фиксировались.
В ходе эндоскопического исследования у двух пациентов из I группы была диагностирована умеренная атрофия слизистой желудка. По результатам гистологического анализа биоптатов из пораженных участков, железы были слегка укорочены и обрамлены тонкими фиброзными прослойками, в фундальных железах наблюдалась умеренная гиперплазия добавочных гландулоцитов, а главные париетальные гландулоциты сохранили свою целостность, лишь незначительное количество из них было заменено мукоидными. При оценке секреторной функции желудка, согласно данным внутрижелудочной рН-метрии, у пациентов I группы преобладало нормальное кислотообразование тела желудка с субкомпенсацией ощелачивани
Хьюстонская модификация Сиднейской классификации хронического гастрита
Согласно модификации Сиднейской классификации хронического гастрита, представленной в Хьюстоне (1994, 1996), определяют тип гастрита и оценивают три критерия: этиология, топография, морфология. Для применения данной классификации необходимо проведение гистологического исследования не менее 5 гастробиоптатов и обязательно определять Helicobacter pylori.
Каковы основные симптомы и признаки гастрита? Клиническое проявление хронического гастрита не имеет специфики и определяется наличием диспептических симптомов, ассоциированных с гастритом. По нашим данным, 46% пациентов с хроническим гастритом сообщают о диспептических проявлениях. Иногда заболевание протекает бессимптомно.
Хронический хеликобактерный гастрит
Хронический хеликобактерный гастрит может протекать бессимптомно, что наблюдается в 52% случаев. Связь между развитием инфекционного обострения и появлением каких-либо клинических симптомов не обнаруживается.
Хронический хеликобактерный антральный гастрит с высокой кислотопродукцией зачастую ассоциируется с язвоподобными проявлениями диспепсии. Данная форма гастрита может сопровождаться болевыми ощущениями, изжогой, кисловатой отрыжкой, тошнотой и склонностью к запорам. Болевые ощущения возникают через 1,5–2 часа после приема пищи, а иногда позже (поздние боли).
Аппетит обычно не нарушен. Объективно обнаруживается болезненность при пальпации в эпигастральной области, больше справа. По мере прогрессирования хеликобактерного гастрита развивается пангастрит и атрофический гастрит, что и вызывает изменение клинической картины.
Атрофический гастрит
Атрофический гастрит больше всего проявляется дисмоторным вариантом диспепсии. Пациенты жалуются на тяжесть и полноту в эпигастральной области, быстроту насыщения, отрыжку воздухом или при выраженном процессе — тухлым. Часто появляется тошнота. Иногда наблюдаются тупые боли в области эпигастрия, которые усиливаются после еды.
Грубая пища плохо переносится.
Аппетит чаще снижен. Возможен неприятный, часто металлический привкус во рту. Объективно обнаруживается язык, обложенный белым налетом, диффузная болезненность при пальпации в эпигастрии.
Аутоиммунный атрофический гастрит
Аутоиммунный атрофический гастрит. При этом виде гастрита, сопровождаемом дефицитом витамина В12, вышеописанная клиническая картина атрофического гастрита дополняется симптомами анемического синдрома, который характеризуется слабостью, головокружением, астено-невротическими проявлениями, болями в сердце, похожими на ишемические, бледностью кожных покровов и слизистых оболочек, желтушностью склер, «лакированным» языком, умеренным увеличением печени, а также систолическим шумом при аускультации сердца.
Часто любая гастроэнтерологическая патология со временем приводит к сочетанному поражению органов пищеварительной системы. При тяжелом течении хронического атрофического гастрита развивается синдром мальабсорбции.
Химический гастрит
Химический гастрит чаще проявляется симптомами дисмоторной диспепсии. При рефлюкс-гастрите наблюдаются тупые боли в эпигастрии, которые возникают во время или сразу после еды, а также горечь и сухость во рту, отрыжка, тошнота и снижение аппетита. При рефлюкс-гастрите проявления демпинг-синдрома занимают центральное место в клинической картине.
Радиационный гастрит
Радиационный гастрит. Клиническое проявление радиационного гастрита зависит от дозы облучения. При легкой степени лучевой болезни (1–2 Гр) изменения слизистой оболочки желудка минимальны, в то время как при тяжелых стадиях (6–10 Гр) возникают распространенные коагуляционные некрозы с образованием язв и вторичной воспалительной инфильтрации.
Гранулематозный гастрит
Гранулематозный гастрит. В клинической картине гранулематозного гастрита преобладают проявления основного заболевания (болезнь Крона, саркоидоз). Симптоматика этого вида гастрита неспецифична, имеются симптомы диспепсии. При локализации гранулемы в привратнике возможно рвота, при щелевидных язвах в области гранулематозного поражения рвота может быть кровавой.
Лимфоцитарный гастрит
Лимфоцитарный гастрит обычно протекает без симптомов или с общепринятой клинической картиной диспепсии.
Эозинофильный гастрит
Эозинофильный гастрит. Специфических проявлений эозинофильного гастрита нет. При системной склеродермии, полимиозите и дерматомиозите у больных эозинофильным гастритом эозинофилия в периферической крови отсутствует.
Инфекционный гастрит
Инфекционный гастрит. Характер инфекционного гастрита во многом зависит от причины его возникновения.
Коллагенозный гастрит
При коллагенозном гастрите клинические признаки могут отсутствовать.
Болезнь Менетрие
Болезнь Менетрие. Какие основные симптомы болезни Менетрие? При болезни Менетрие пациенты жалуются на боли в эпигастральной области, возникающие после еды, проявления дисмоторного диспептического синдрома, изжогу. Возможно рвота, иногда с примесью крови. Аппетит снижен, отмечаются слабость, иногда диарея.
При этом могут наблюдаться снижение веса, отеки на стопах и руках, связанные с гипопротеинемией, а также железодефицитная анемия и гипоальбуминемия (обусловленные выделением альбумина в полость желудка).
Гистологические признаки хеликобактерного гастрита
Основными гистологическими признаками хеликобактерного гастрита являются:
1) выраженная нейтрофильная инфильтрация в ямочном эпителии с повреждением клеток;
2) лимфоцитарная и плазмоцитарная инфильтрация в собственной пластинке;
3) лимфоидные фолликулы;
4) присутствие Helicobacter pylori (обычно наблюдается при неатрофическом гастрите).
Дополнительными гистологическими признаками хеликобактерного гастрита являются:
1) кишечная метаплазия эпителия;
2) атрофические изменения;
4) изъязвление слизистой оболочки желудка.
ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ КЛЕТОЧНЫХ АССОЦИАЦИЙ В БИОПСИЙНОМ МАТЕРИАЛЕ ПРИ БОЛЕЗНИ КРОНА
Болезнь Крона (БК) — это хроническое рецидивирующее заболевание неясной природы, основным проявлением которого является трансмуральное воспаление, затрагивающее сегменты различных частей пищеварительной системы [1-6].
Согласно клиническим рекомендациям по диагностике и лечению взрослых пациентов с болезнью Крона, разработанные экспертной комиссией «Российской гастроэнтерологической ассоциации» и «Ассоциации колопроктологов России» (Москва, 2013), есть 6 ключевых признаков заболевания:
1. Затрагивает область от ротовой полости до ануса: хроническое гранулематозное воспаление слизистой губ или щек; уражение пилородуоденальной области, тонкой кишки, хронические поражения перианальной области.
2. Прерывистый характер поражения стенки кишечника.
3. Трансмуральный характер поражения: язвы- трещины, абсцессы, свищи.
4. Фиброз: стриктуры.
5. Лимфоидная ткань (гистология): афтоидные язвы или трансмуральные лимфоидные скопления.
7. Наличие саркоидной гранулемы.
Диагноз БК считается установленным, если обнаружено три любых признака или гранулема в сочетании с другим признаком.
Из данных рекомендаций видно, что наличие гранулемы является определяющим при постановке диагноза. Однако при гистологическом исследовании биопсий гранулемы обнаруживаются только в 15-36% случаев.
Дополнительные морфологические признаки включают:
• Глубокие щелевидные язвы, проникающие в подслизистую основу или мышечный слой;
• Фокальная лимфоплазмоцитарная инфильтрация в собственной пластинке слизистой оболочки;
• Трансмуральное воспаление с лимфоидной гиперплазией во всех слоях стенки кишки;
• Поражение подвздошной кишки со структурными изменениями ворсин, мукоидной или псевдопилорической метаплазией крипт и хроническим активным воспалением;
• Прерывистое поражение, проявляющееся чередованием пораженных и здоровых участков кишки (при исследовании резецированного фрагмента кишки). В отличие от язвенного колита, крипт-абсцессы при болезни Крона появляются редко, а секреция слизи сохраняется на нормальном уровне.
Для постановки диагноза БК специалисту-морфологу необходимо учитывать разные варианты клеточной инфильтрации собственной пластинки слизистой кишечника. В настоящей работе мы представили основные морфологические элементы болезни Крона в различных вариантах их проявлений в порядке значимости для морфологического диагноза данного заболевания и качественной оценки его активности.
Методы и материалы: биоптаты толстой кишки были получены от 14 пациентов с клиническим диагнозом «болезнь Крона», подтвержденным морфологическим исследованием. Срезы окрашивались гематоксилин-эозином и анализировались под микроскопом с использованием системы видеофиксации.
Результаты наших исследований:
В получаемом на практике биопсийном материале встречаются как относительно неизмененные фрагменты слизистой толстого кишечника, так и биоптаты слизистой оболочки с очагами дистрофии покровного эпителия, поверхностными эрозиями и усилением лимфоплазмоцитарной инфильтрации поверхностных отделов слизистой с примесью нейтрофилов. Наблюдается усиление эрозивных поражений эпителиального покрова толстого кишечника, появление язвенных дефектов слизистой. В собственной пластинке слизистой одновременно наблюдается выраженная очаговая межуточная лимфоплазмоцитарная инфильтрация с примесью многочисленных нейтрофилов. В отдельных случаях – с выраженной лимфоплазмоцитарной инфильтрацией с примесью эозинофилов.
В изученных биопсиях выявлены следующие морфологические характеристики болезни Крона:
1. Щелевидные язвы (Встречаемость: редкая).
2. Гранулемы с гигантскими клетками Пирогова-Лангханса в верхних слоях собственной пластинки слизистой (встречаемость: редкая).
3. Гранулемы без гигантских многоядерных клеток в глубоких слоях собственной пластинки слизистой (встречаемость: средняя).
4. Гранулемы с единичными (иногда множественными) гигантскими многоядерными клетками в глубоких отделах собственной пластинки слизистой (встречаемость: средняя). Гранулемы окружены выраженной лимфоплазмоцитарной инфильтрацией с примесью нейтрофилов.
5. Гранулемы в подслизистом и мышечном слоях (встречаемость: частая).
1. Варианты клеточных ассоциаций при болезни Крона позволяют предположить наличие стадийности развития ее морфологических проявлений (появление лимфо- плазмоцитарных скоплений в пораженном отделе стенки кишечника с примесью нейтрофилов, присоединение эозинофилии, появление эрозивно-язвенных поражений слизистой и щелевидных язв, появление гранулём с многоядерными клетками).
2. Присутствие эозинофилов в биоптате к лимфоплазмоцитарной инфильтрации значительно осложняет дифференциальную диагностику болезни Крона и неспецифического язвенного колита.
3. Относительная редкость нахождения гранулем при болезни Крона может быть связана с поверхностным забором биопсий, что затрудняет постановку точного диагноза этого заболевания.
Вопросы по теме
Какова роль плазмоцитов в иммунитете желудка?
Плазмоциты — это клетки, являющиеся конечной стадией дифференцировки В-лимфоцитов, которые играют ключевую роль в производстве антител. В желудке плазмоциты помогают поддерживать местный иммунитет, защищая слизистую оболочку органа от инфекций и других патогенных агентов. Плазмоцитарная инфильтрация может свидетельствовать о том, что организм активно борется с воспалительными процессами или инфекцией, однако чрезмерное количество этих клеток может указывать на хроническое воспаление или более серьезные заболевания.
Какие симптомы могут указывать на плазмоцитарную инфильтрацию желудка?
Симптомы плазмоцитарной инфильтрации желудка могут быть весьма разнообразными и зависят от первопричины данного состояния. Наиболее распространенные симптомы включают боль в верхней части живота, диспепсические расстройства (тошнота, изжога, вздутие), потерю аппетита и, в некоторых случаях, анемию. Важно отметить, что наличие признаков не всегда указывает на плазмоцитарную инфильтрацию, и для точной диагностики требуется медицинское обследование.
Как проводится диагностика плазмоцитарной инфильтрации желудка?
Диагностика плазмоцитарной инфильтрации желудка включает несколько этапов. В первую очередь, врач проводит обширный сбор анамнеза, выясняя симптомы, возможные факторы риска и предшествующие заболевания. Следующим шагом может быть эндоскопическое исследование (гастроскопия), которое позволяет визуально оценить состояние слизистой оболочки желудка и, при необходимости, взять биопсию для гистологического исследования. Гистологический анализ образца ткани поможет определить наличие плазмоцитарной инфильтрации и выявить причины, которые к ней привели.